Слайд 2

Относительная плотность вещества Х по газу У — DпоУ(Х)
Dпо У(X)= M(
в-ва Х)/М(газа У)
Например,
D по Н2 (СхНу)=29, D по Н2 (СхНу)= M(CxHy)/М(Н2)
М(СхНу)=D по Н2 *М(Н2)=29*2=58 г/моль
Слайд 3

Определите молекулярную формулу углеводорода, если массовая доля углерода равна 84,21%, а
водорода –15,79%. Относительная плотность этого вещества по воздуху примерно равна 3,931. Молярная масса воздуха 29 г/моль
Слайд 4

1. СxHy-формула нашего углеводорода
Пусть m(СxHy) =100 г.Тогда m( С )= 84,21 г,
а m(Н) = 15,79 г.
Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль.
Определяем cоотношение индексов в формуле( совпадает с мольным соотношением атомов С и Н):
х:у= ν(C) : ν(H) = 7,0175 : 15,79 (сократим оба числа, разделив на наименьшее) = 1 : 2,25 (домножим на 4) = 4 : 9. Таким образом, простейшая формула — С4Н9.
4. По относительной плотности рассчитаем молярную массу: М = D(возд.) • М возд= 3,931 • 29 = 114 г/моль. Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинной молярной массы. Значит, истинная формула — С8Н18.
Слайд 5

Экспериментально установлено, что элементный состав газообразного вещества следующий: массовая доля углерода
0,8571 (или 85,71%), массовая доля водорода 0,1429 (или 14,29%). Относительная плотность этого вещества по водороду (Н2)=14.Определите молекулярную формулу этого вещества
Слайд 6

1. СxHy-формула нашего углеводорода
Пусть m(СxHy) =100 г. Тогда m( С )= 85,71
г, а m(Н) = 14,29 г.
Найдём количество вещества каждого атома:
ν(C) = m / M = 85,71 / 12 = 7,1425 моль,
ν(H) = 14,29 / 1 = 14,29 моль.
Определяем cоотношение индексов в формуле( совпадает с мольным соотношением атомов С и Н):
х:у= ν(C) : ν(H) = 7,1425 : 14,29 (сократим оба числа, разделив на наименьшее) = 1 : 2 Таким образом, простейшая формула — СН2.
4. По относительной плотности рассчитаем молярную массу: М = D(Н2) • М (Н2)= 2 • 14 = 28 г/моль. Молярная масса, соответствующая простейшей формуле СН2— 14 г/моль, это в 2 раза меньше истинной молярной массы. Значит, истинная формула — С2Н4.
СН2=СН2 - этилен





 Элементы группы галогенов
Элементы группы галогенов Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов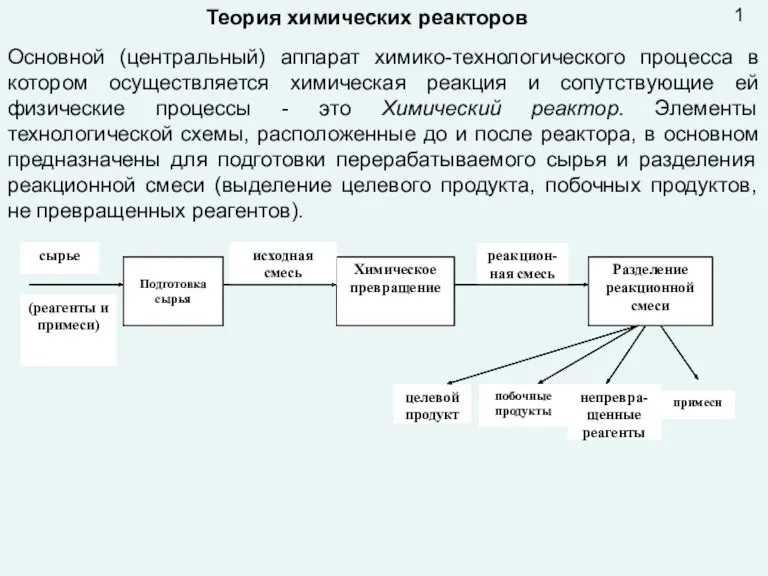 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Три кити нанохімії
Три кити нанохімії Углепластики
Углепластики Растворы. Концентрация растворов
Растворы. Концентрация растворов Арены. Бензол
Арены. Бензол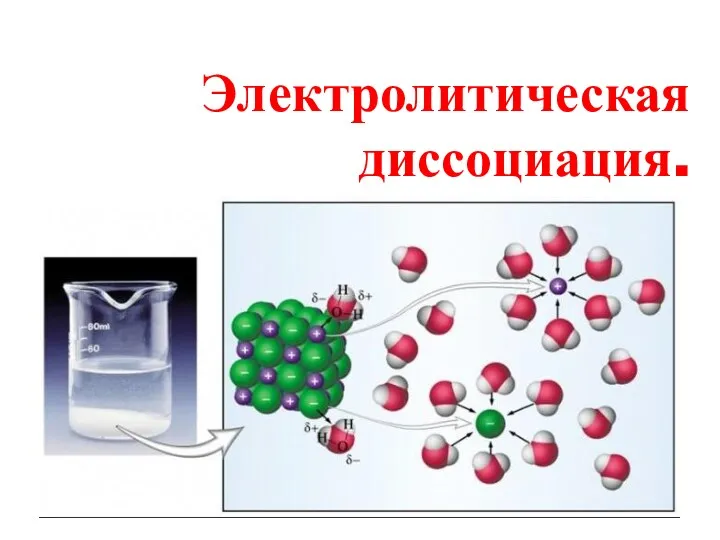 Электролитическая диссоциация
Электролитическая диссоциация Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Закон сохранения массы вещества
Закон сохранения массы вещества Жесткость воды
Жесткость воды Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Склад і властивості нафти
Склад і властивості нафти Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основания. Названия оснований
Основания. Названия оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Обмен липидов-1
Обмен липидов-1 Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Классификация и свойства оксидов
Классификация и свойства оксидов