Слайд 2(двух центровые – двух электронные)
между комплексообразователем и лигандом
Слайд 3Орбитальное взаимодействие
в октаэдрическом комплексе с 6 одинаковыми лигандами
Слайд 4Построение схемы
молекулярных орбиталей в октаэдре
Общие принципы:
Центральный атом предоставляет 9 орбиталей–
5АО (n–1)d, 1АО
ns, 3АО np(по возрастанию энергии);
для 3-d металлов: 5(3d)+1(4s)+3(4p)=9АО.
2. Шесть лигандов предоставляют по одной орбитали
σ-симметрии каждая.
3. Орбитали лигандов рассматриваются не независимо, а в совокупности (подход групповых орбиталей).
4. Число молекулярных орбиталей равно сумме атомных орбиталей (правило МО-ЛКАО).
5. Взаимодействие орбиталей может быть конструктивным (связывающее), деструктивным (разрыхляющее) и безразличным (несвязывающее).
В октаэдрическом поле с 6 орбиталями лигандов перекрываются валентные орбитали 3-d металлов: 2АО (3dz2 и 3dx2-y2)+1АО (4s)+3АО (4p) в соответствии с их пространственной ориентацией вдоль осей координат. Из них образуются 6σсвяз МО и 6σ*разр МО. Три валентные орбитали: dxy, dxz, dyz ориентированы между осями координат, так что их перекрывание с орбиталями лигандов невозможно. Из них образуются несвязывающие МО.
Слайд 13Энергетическая диаграмма МО для октаэдрических комплексов:
высокоспинового [FeF6]4- (а) и низкоспинового [Fe(CN)6]4- (б)
Слайд 14Энергетическая диаграмма молекулярных орбиталей в тетраэдрическом комплексе
Слайд 15Энергетическая диаграмма молекулярных орбиталей в плоско квадратном комплексе
 Хімічний зв’язок
Хімічний зв’язок Термический анализ
Термический анализ Стереоселективные синтезы
Стереоселективные синтезы Аммиак. Состав вещества
Аммиак. Состав вещества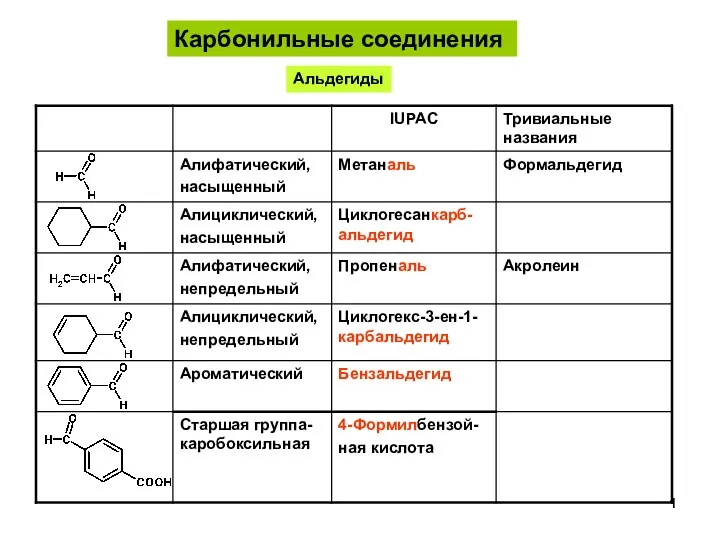 АльдегидыКетоны-1
АльдегидыКетоны-1 Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Химические свойства металлов
Химические свойства металлов Химические реакции
Химические реакции Осмий. Применение
Осмий. Применение Химия радиоактивных элементов
Химия радиоактивных элементов Горение топлива
Горение топлива Предельные углеводороды и их производные
Предельные углеводороды и их производные Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Магматические формации
Магматические формации Металдарға қандай физикалық қасиеттер тән?
Металдарға қандай физикалық қасиеттер тән? Титан. Хром
Титан. Хром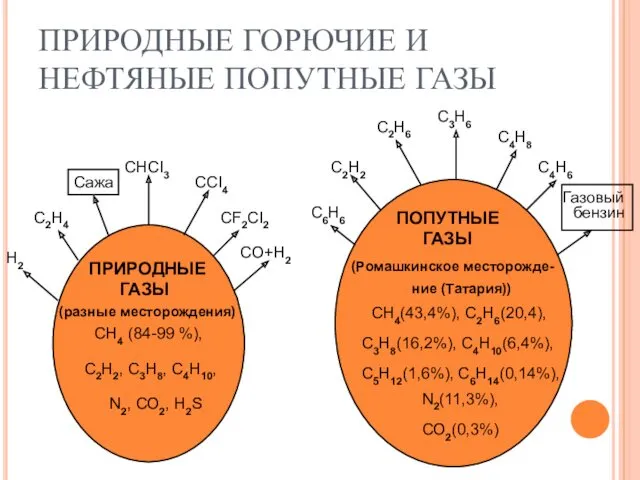 ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Сера. Нахождение в природе. Химические свойства серы
Сера. Нахождение в природе. Химические свойства серы Щелочноземельные металлы
Щелочноземельные металлы Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Составление формул химических соединений
Составление формул химических соединений Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Хроматографические методы в аналитической химии
Хроматографические методы в аналитической химии Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Методы очистки нефтяных фракций
Методы очистки нефтяных фракций Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Полипропилен
Полипропилен