Содержание
- 2. “ Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется,
- 3. Современная формулировка закона сохранения массы веществ: Масса веществ,вступивших в химическую реакцию,равна массе веществ,получившихся в результате её.
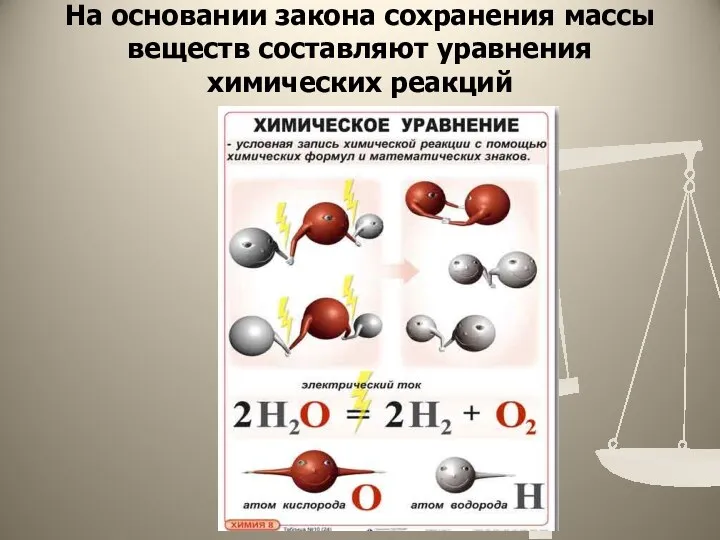
- 4. На основании закона сохранения массы веществ составляют уравнения химических реакций
- 5. Химическим уравнением - называют условную запись химической реакции с помощью химических формул и математических знаков (индексов
- 6. Правила составления химических уравнений 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку а)
- 7. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 8. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
- 9. Алгоритм расстановки коэффициентов в уравнении химической реакции. 1. Подсчитать количество атомов каждого элемента в правой и
- 10. 2. Определить, у какого элемента количество атомов меняется, найти Н.О.К. N2 + H2 → NH3 2
- 11. 3. Разделить Н.О.К. на индексы – получить коэффициенты Поставить коэффициенты перед формулами 1N2 + 3H2 →
- 12. 4. Пересчитать количество атомов, при необходимости действия повторить N2 + 3H2 → 2NH3 2 6 6
- 13. 5. Начинать лучше с атомов О или любого другого неметалла (если только О не находится в
- 14. Расставьте коэффициенты: а) О2 + H2 → H2O б) Al(OH)3 → Al2O3 + H2O в) Mg
- 15. Проверь себя: а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg
- 16. Новые вещества не получаются из ничего и не могут обратиться в ничто. При химических реакциях происходит
- 17. Расставьте коэффициенты: P + Cl2 → PCl5 Na + S → Na2S HCl + Mg →
- 19. Скачать презентацию












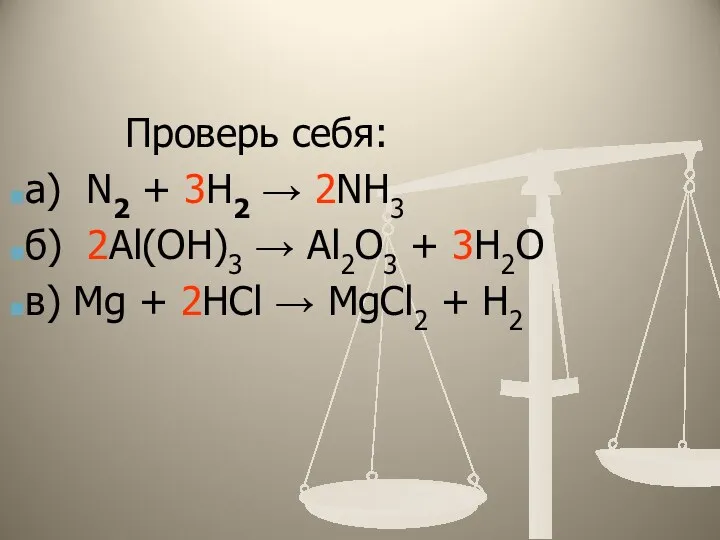


 Титриметрический метод анализа
Титриметрический метод анализа Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы
Мектепте химия пәнінен олипиядалық есептерді шешуде иондар қасиеттерінің маңызы Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров Как и где используется соляная кислота
Как и где используется соляная кислота Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Галогены. История открытия галогенов
Галогены. История открытия галогенов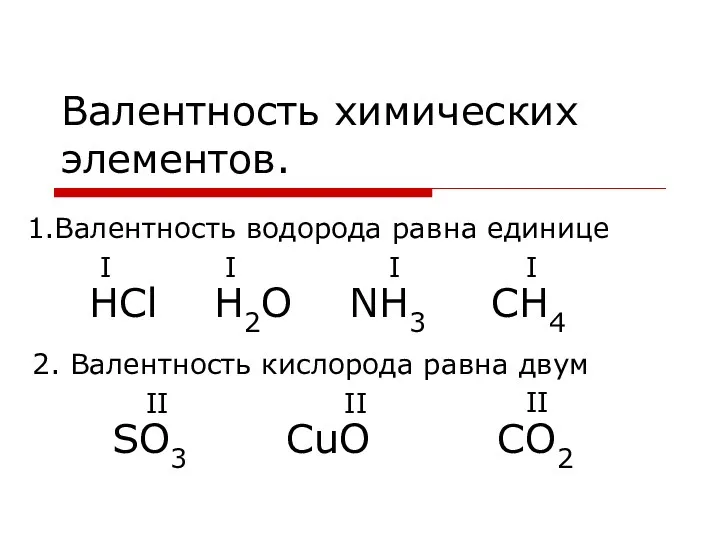 Валентность химических элементов
Валентность химических элементов Золото
Золото Перманганат калия
Перманганат калия Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Катализ и катализаторы
Катализ и катализаторы Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Метанол. Фізичні властивості
Метанол. Фізичні властивості Тепловой эффект химических реакций
Тепловой эффект химических реакций Получение и применение альдегидов
Получение и применение альдегидов Процесс электролиза
Процесс электролиза Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Формы залегания метаморфических пород
Формы залегания метаморфических пород Цікаві факти про хімію
Цікаві факти про хімію Задачи на избыток-недостаток
Задачи на избыток-недостаток Розчин та його компоненти
Розчин та його компоненти Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов