Слайд 2

Основные понятия и определения
Хим. термодинамика –
Термодинамическая система (ТДC) –
Открытая ТДС
–
Закрытая ТДС –
Изолированная ТДС –
Слайд 3

Основные понятия и определения
Химический компонент –
Различают: одно-, двух-, многокомпонентные системы.
Фаза –
Гомогенная система
– система, состоящая из одной фазы.
Гетерогенная система – система, состоящая из нескольких фаз.
Слайд 4

Основные понятия и определения
Параметры состояния –
Изотермические процессы: Т = const
Изобарные: Р
= const
Изохорные: V = const
ТД функции – это харак-тики состояния ТДС, которые зависят от простых параметров:
U – внутренняя энергия
Н – энтальпия
S – энтропия
G – энергия Гиббса
Слайд 5

Внутренняя энергия
Внутренняя Е - это
Абсолютное значение внутренней Е измерить невозможно.
ΔU
– изменение внутренней Е
Слайд 6

Первый закон термодинамики
Теплота (Q), полученная ТДС, расходуется на изменение её внутренней
Е (ΔU) и совершение работы (А).
Q = ΔU + А
А – суммарная работа, совершаемая системой.
Слайд 7

Энтальпия
ΔH = ΔU + p·ΔV
Изменение энтальпии равно изменению внутренней
Е ТДС и совершению работы расширения.
Qp = |ΔH|
Тепловой эффект при постоянном давлении равен изменению энтальпии.
Слайд 8

Стандартная энтальпия
Стандартная энтальпия (ΔHо) – изменение энтальпии реакции в стандартных
условиях.
Стандартные условия
Давление 1,013·105 Па
Температура 298 К (как правило)
Слайд 9
![Стандартная энтальпия образования вещества ΔfHо – [ΔfHо] = кДж/моль ΔfHо](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/338675/slide-8.jpg)
Стандартная энтальпия образования вещества
ΔfHо –
[ΔfHо] = кДж/моль
ΔfHо простых в-в
в термодинамически устойчивом состоянии равны 0.
Слайд 10

Термохимические уравнения
Хим. уравнение реакции:
2Н2 + О2 = 2Н2О
Термохимическое урав-ие р-ции:
Н2(г) +
1/2О2(г) = Н2О(г); ΔfНо (Н2О) = - 241,8 кДж/моль
Слайд 11

Закон Гесса
Энтальпия химической реакции
1840 г. Г.И. Гесс
Тепловой эффект хим. р-ции
(энтальпия р-ции) не зависит от пути её протекания, а определяется только начальным и конечным состоянием исходных в-в и продуктов р-ции.
Слайд 12

Второй закон термодинамики
В изолированной системе любой самопроизвольный процесс протекает в направлении,
при котором система переходит из менее вероятного состояния в более вероятное.
Слайд 13

Третий закон термодинамики
Энтропия правильного кристалла стремится к 0 по мере приближения
температуры к абсолютному 0.
Слайд 14

Энтропия
В изолированной системе S является критерием самопроизвольности протекания процесса.
Процессы протекают самопр-но
в направлении ув-ия энтропии.
ΔS > 0 процесс протекает самопр-но
ΔS < 0 процесс не протекает самопр-но
ΔS=0 система находится в состоянии равновесия
Энтропия явл-ся функцией состояния.
Изменение S при протекании хим. р-ции рассчит-ся также как ΔrHо, по закону Гесса:
ΔrSо = ΣSопродуктов - ΣSо исх. в-в
Слайд 15

Направление протекания химических процессов.
ΔG = ΔH - ТΔS
ΔG – энергия
Гиббса - функция состояния ТДС, характеризующая возможность самопр-ного протекания хим. проц.







![Стандартная энтальпия образования вещества ΔfHо – [ΔfHо] = кДж/моль ΔfHо](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/338675/slide-8.jpg)






 Классификация химических элементов
Классификация химических элементов Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)
Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс) Алкины. Непредельные углеводороды
Алкины. Непредельные углеводороды Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Химические элементы в организме человека
Химические элементы в организме человека Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Непредельные углеводороды
Непредельные углеводороды Химические свойства получение и применение солей
Химические свойства получение и применение солей Роль хімії в природі
Роль хімії в природі Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот
Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот Кислотно-основные равновесия. Введение в титриметрию
Кислотно-основные равновесия. Введение в титриметрию Фтор (Fluorum), F
Фтор (Fluorum), F Опасности среды обитания человека
Опасности среды обитания человека Строение атома. Химическая связь
Строение атома. Химическая связь Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов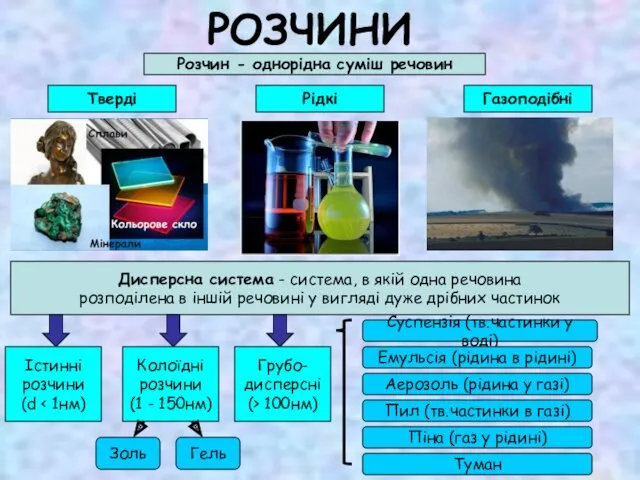 Розчини
Розчини Открытие периодического закона
Открытие периодического закона Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Основные характеристики различных сортов меда
Основные характеристики различных сортов меда Тыңайтқышты тиімді пайдалансақ
Тыңайтқышты тиімді пайдалансақ Волшебные кристалы
Волшебные кристалы М.В.Ломоносов о пользе стекла
М.В.Ломоносов о пользе стекла Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Электоролиз заңы
Электоролиз заңы