Содержание
- 2. Цели урока: познакомить учащихся с основными способами решения задач по химическим уравнениям: находить количество, массу и
- 3. Какое явление не является признаком химических превращений: а) появление осадка; б) выделение газа; в) изменение объема;
- 4. «Куча мала» 4Al + 3O2 = 2Al2O3 MgCO3= MgO + CO2 2HgO= 2Hg + O2 2Na
- 5. Алгоритм решения расчетных задач с использованием уравнений химических реакций. 1. Внимательно прочитайте текст задачи 2. Составьте
- 6. Задача 1. Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 г. Дано: m(Н20)
- 7. Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические
- 8. Следовательно, n(O2)=0,25 моль Найдем массу вещества, которую требуется вычислить m(O2)= n(O2)*M(O2) m(O2) = 0,25 моль •
- 9. Задача 2 Вычисление объема вещества по известной массе другого вещества, участвующего в реакции Вычислите объем кислорода
- 10. Запишем уравнение реакции. Расставим коэффициенты 2Н2О = 2Н2 + О2 Над формулой в уравнении реакции запишем
- 11. Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию 0,5моль х моль 2 моль
- 12. Задачи для самостоятельного решения При восстановлении углем оксидов Fe2O3 и SnO2 получили по 20 г Fe
- 13. Решение задачи 1. Дано: Решение: m(Fe) = 20г n(Fe)= m/M, n(Fe) = 20г/56г/моль=0,36моль m(Fe2O3)=? хмоль 0,36моль
- 14. Решение задачи 2 Дано: Решение: m(Cu2O)=10г m (CuO)=10г 1. Cu2O + H2 = 2Cu + H2O
- 15. CuO + H2 = Cu + H2O n(CuO) = m/ M(CuO) n(CuO) = 10г/ 80г/моль =
- 16. Домашнее задание изучить материал учебника с. 45-47, решить задачу Какую массу оксида кальция и какой объём
- 18. Скачать презентацию















 Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Гидролиз солей
Гидролиз солей Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Типы химических реакций
Типы химических реакций Оксид фосфора P2O5
Оксид фосфора P2O5 Растворы электролитов
Растворы электролитов Адсорбция. Раздел III
Адсорбция. Раздел III Целлюлоза. Строение
Целлюлоза. Строение Электролитическая диссоциация
Электролитическая диссоциация Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Алкины. Гомологический ряд
Алкины. Гомологический ряд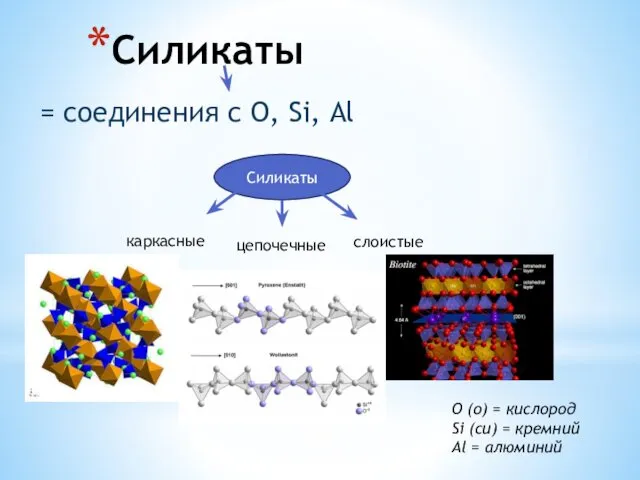 Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Производные фенантренизохинолина
Производные фенантренизохинолина Химические свойства неорганических соединений. Лабораторная работа
Химические свойства неорганических соединений. Лабораторная работа Вещества и их свойства
Вещества и их свойства Теория электролитической диссоциации
Теория электролитической диссоциации Нитросоединения
Нитросоединения Арены. Бензол
Арены. Бензол Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота
Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота ЛРС и производящие растения, содержащие полисахариды
ЛРС и производящие растения, содержащие полисахариды Полимеры. Полимерные материалы
Полимеры. Полимерные материалы General properties Transition Metals
General properties Transition Metals Соли
Соли