Содержание
- 2. НNО3, Н2SО4, Н3РО4 Таблица 1.
- 3. щавель Крапива
- 4. Кислоты
- 5. HCl - хлороводородная(соляная) H2S - сероводородная HNO3 - азотная HNO2 - азотистая H2SO4 - серная H2SO3
- 6. Определение степени окисления элементов H2SO4
- 7. Классификация кислот HF - фтороводородная HCl - хлороводородная HBr - бромоводородная HI - йодоводородная H2S -
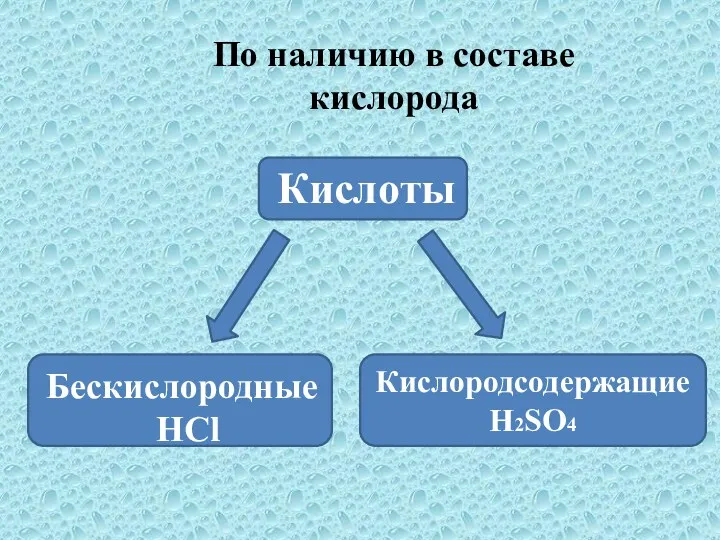
- 8. По наличию в составе кислорода Кислоты Бескислородные HCl Кислородсодержащие H2SO4
- 9. По какому признаку кислоты разделены на группы HF - фтороводородная HCl - хлороводородная HBr - бромоводородная
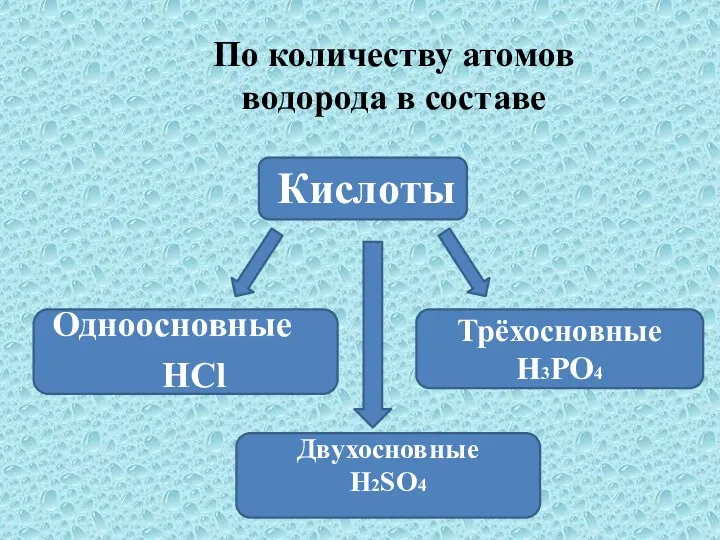
- 10. По количеству атомов водорода в составе Кислоты Одноосновные НCl Трёхосновные H3PO4 Двухосновные Н2SO4
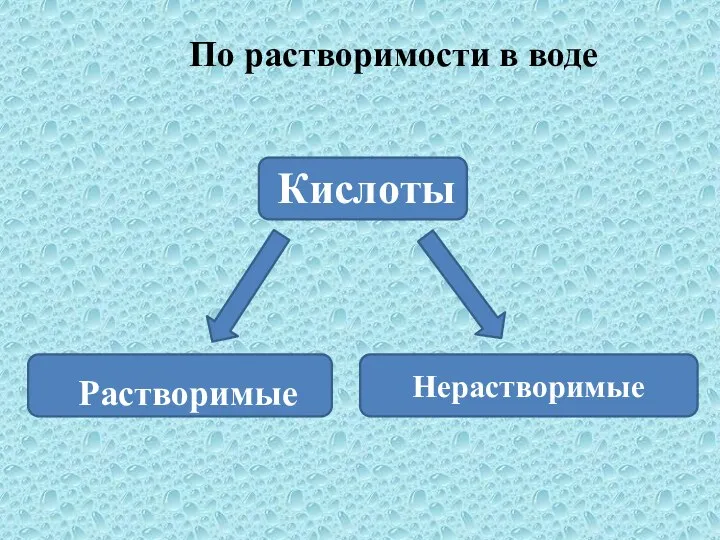
- 11. По растворимости в воде Кислоты Растворимые Нерастворимые
- 12. Физические свойства кислот По агрегатному состоянию: Газообразные (HCl, H2S) Жидкие (HNO3, H2SO4) Твердые (H3PO4, H2SiO3)
- 13. Серная кислота Бесцветная жидкость, вязкая как масло, тяжелее воды. Растворять кислоту в воде необходимо очень осторожно,
- 16. Угольная и сернистая кислоты - H2CO3 и H2SO3 в свободном виде не существуют, т.к. они разлагаются
- 17. Правила техники безопасности при работе с кислотами Не нюхать! Не пробовать! Не разливать! О любых проблемах
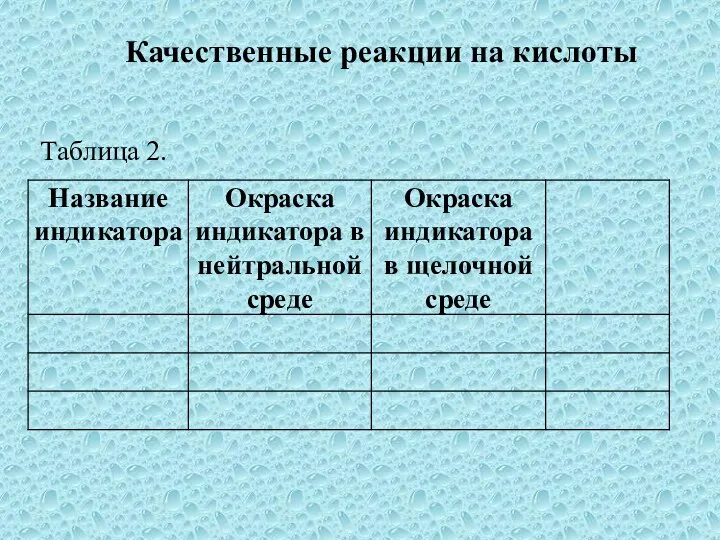
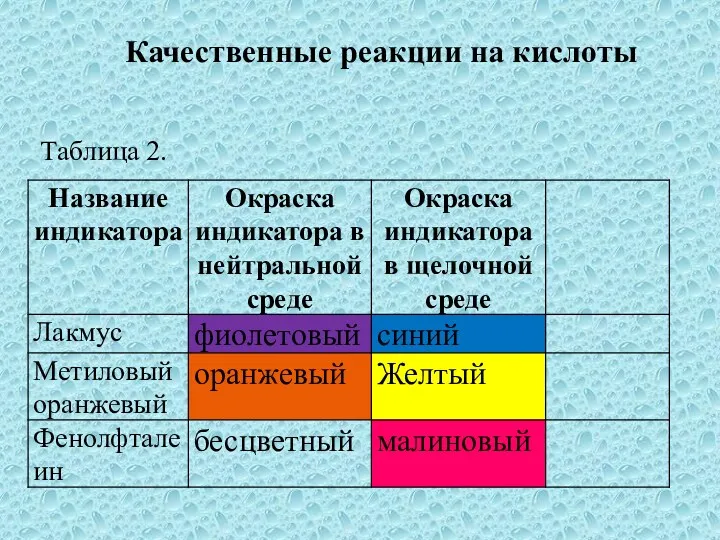
- 18. Таблица 2. Качественные реакции на кислоты
- 19. Таблица 2. Качественные реакции на кислоты
- 20. Таблица 2. Качественные реакции на кислоты
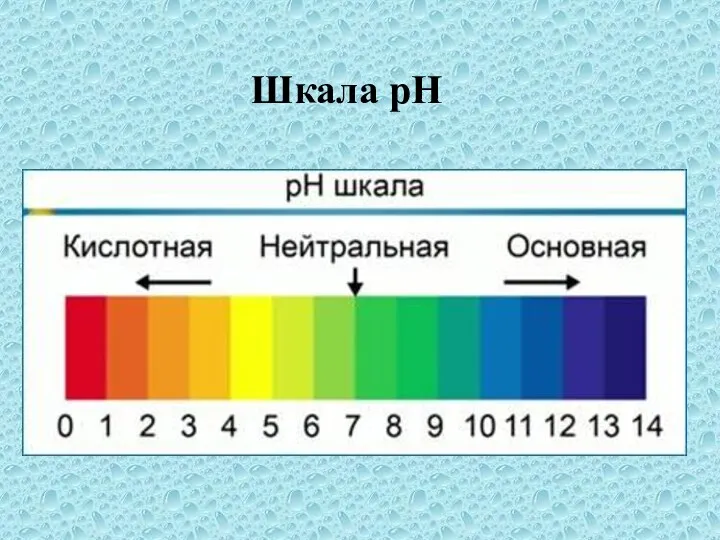
- 21. Шкала рН
- 22. HNO3 - HNO2 - H2SO4 - H2SO3 - H2CO3 - H2SiO3- H3PO4 - Найти степень окисления
- 24. Скачать презентацию















 Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Силикатное производство
Силикатное производство Кислород и его применение
Кислород и его применение Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Типы химических реакций
Типы химических реакций Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Чистые вещества и смеси
Чистые вещества и смеси Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Алюминий и его соединения
Алюминий и его соединения Электрохимические процессы
Электрохимические процессы Мартенситное превращение
Мартенситное превращение Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Основания. Названия оснований
Основания. Названия оснований Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Чистые вещества и смеси
Чистые вещества и смеси Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Кислоты. Определение и классификация
Кислоты. Определение и классификация Оценка химической обстановки при авариях на химически опасных объектах. Расчет
Оценка химической обстановки при авариях на химически опасных объектах. Расчет Теория сплавов
Теория сплавов Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Biomass Feedstocks
Biomass Feedstocks Алотропні форми Карбону
Алотропні форми Карбону Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність