Содержание
- 2. Найпоширеніший серед металів 6,6 ат. % 250 мінералів Al2O3·2SiO2·2H2O Al2O3 – корунд (рубін, сапфір) Na2O(K2O)·Al2O3·2SiO2 –
- 3. Добування 3Na2CO3 + 2Al(OH)3 + 12HF → 2Na3[AlF6] + 3CO2 + 9H2O Al2O3 tпл = 20450С
- 4. К(-) Al3+ + 3e → Al A(+) 4AlO3 – 12e → 2Al2O3 + 3O2 K(-) та
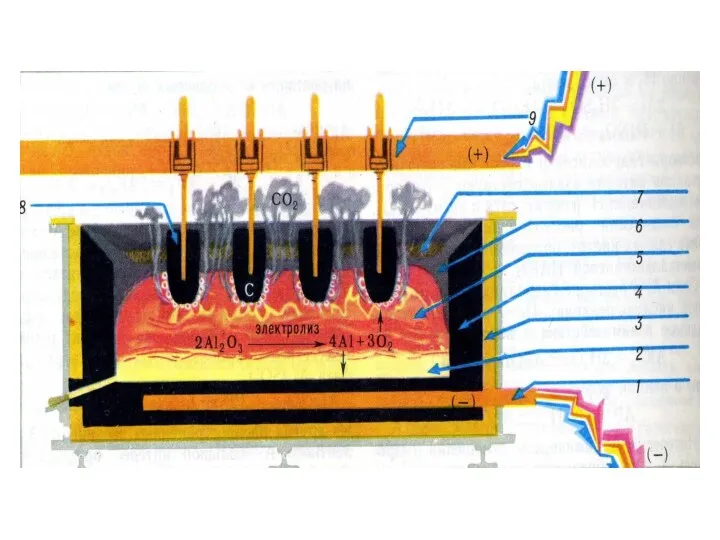
- 6. 1-катод; 2-розплавленний алюміній; 3-теплова ізоляція; 4-вугільна обкладка; 5-розплавлений електроліт; 7-шар Al2O3; 8-вугільні аноди. Електроліт для добування
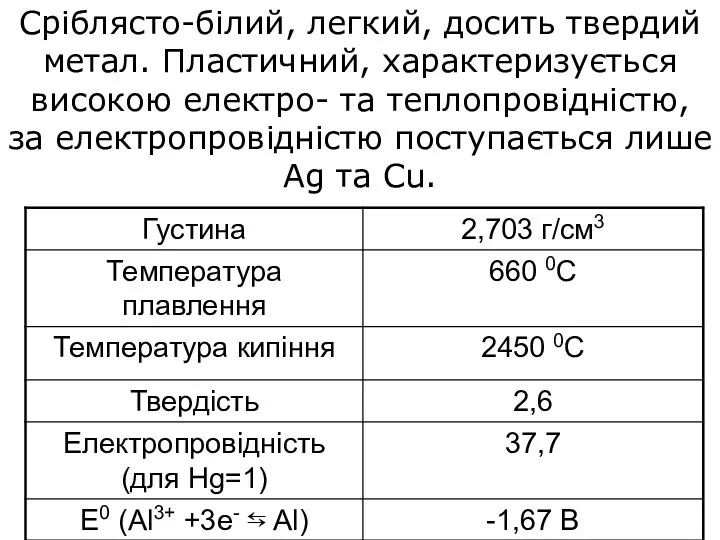
- 7. Сріблясто-білий, легкий, досить твердий метал. Пластичний, характеризується високою електро- та теплопровідністю, за електропровідністю поступається лише Ag
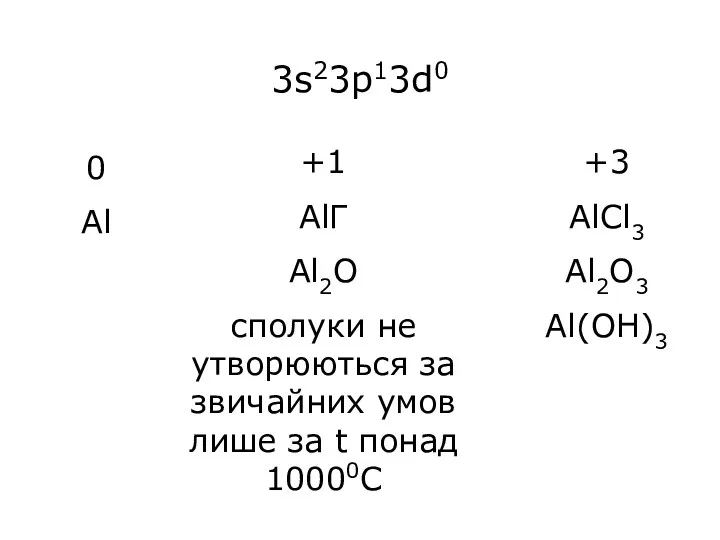
- 8. 3s23p13d0 0 Al +1 AlГ Al2O сполуки не утворюються за звичайних умов лише за t понад
- 9. За високих температур Al реагує з усіма неметалами, крім водню 2Al + 3Г2 → 2AlГ3 (Г
- 10. 2Al + 6H+ → 2Al3+ + 3H2↑ 2Al + 12OH- + 3H2O → 2[Al(OH)6]3- + 3H2↑
- 11. 2Al + 4H2SO4(конц.) → Al2(SO4)3 + S + 4H2O 8Al + 3Fe3O4 → 9Fe + 4Al2O3
- 12. AlH3 + 3H2O → Al(OH)3 + 3H2↑ AlH3 реагує з гідридами лужних металів (за рахунок вакантних
- 13. 4Al + 3O2 → 2Al2O3 Al2O3 (глинозем) – біла тугоплавка не розчинна у воді речовина Відомі
- 14. α – Al2O3 хімічно інертний Не розчиняється у воді, розчинах кислот і лугів Перевести α –
- 15. Υ -Al2O3 не розчиняється у воді, але розчиняється у розчинах кислот та лугів Al2O3 + 6NaOH
- 16. Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + Na2SO4 Al3+ + 3OH- → Al(OH)3↓ Al(OH)3 – амфотерна сполука
- 17. [Al(H2O)6]3+ ⇄ [Al (OH)3(H2O)3] ⇄ [Al(OH)6]3- Кислотні й основні властивості Al(OH)3 виражені слабо: HAlO2 ⇆ H+
- 18. Al2(SO4)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3Na2SO4 2Al3+ + 3CO32- + 3H2O
- 19. Al2(SO4)3 + 6NH4OH → 2AlO(OH)↓ + + 3(NH4)2SO4 + 2H2O Al(OH)3∙ nH2O “старіння” [Al(OH)3]n → [AlO(OH)]n
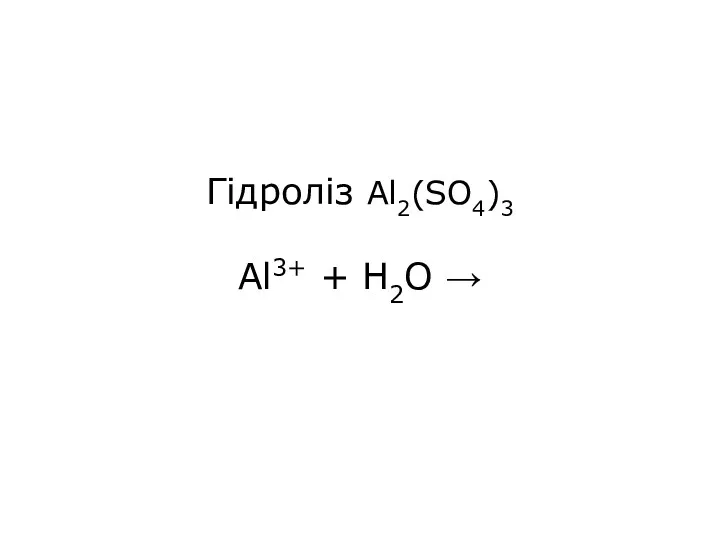
- 21. Гідроліз Al2(SO4)3 Al3+ + H2O →
- 22. [Al(H2O)6]3+ + H2O ⇆ [AlOH(H2O)5]2+ + H3O+
- 23. [Al(H2O)6]3+ + H2O⇆ [AlOH(H2O)5]2+ + H3O+ K = 1·10-5 [AlOH(H2O)5]2+ + H2O ⇆ [Al(OH)2(H2O)4]+ + H3O+
- 24. Галогеніди AlГ3 утворюються не тільки за безпосередньої взаємодії Al з галогенами, але й з оксиду 2Al
- 25. AlF3 не розчинний у воді і має високу температуру плавлення (1040 0С) AlF3 + 3NaF →
- 26. Сполуки з іншими неметалами 2NH3 + 2Al → 2AlN + 3H2↑ AlN + 3H2O → Al(OH)3
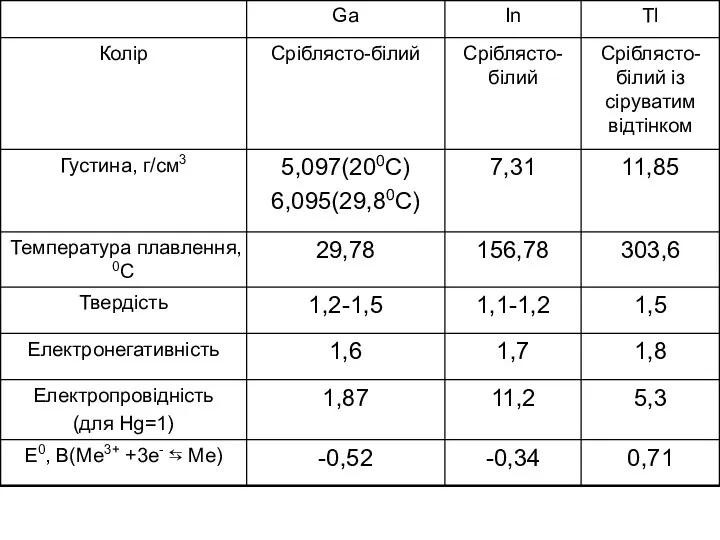
- 27. Ga In Tl
- 29. Хімічні властивості На повітрі Ga та In зберігають блиск, а Tl на свіжому розрізі тьмяніє Ga
- 30. In + 6HNO3 → In(NO3)3 + 3NO2 + 3H2O 2Ga + 3H2SO4 → Ga2(SO4)3 + 3H2↑
- 31. За нагрівання усі три метали бурхливо взаємодіють з киснем Me + O2 → Me2O3 2Tl +
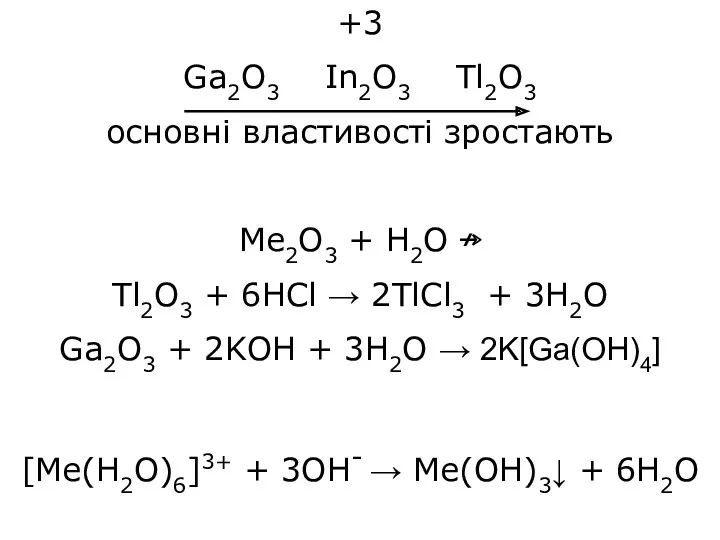
- 32. +3 Ga2O3 In2O3 Tl2O3 основні властивості зростають Me2O3 + H2O ↛ Tl2O3 + 6HCl → 2TlCl3
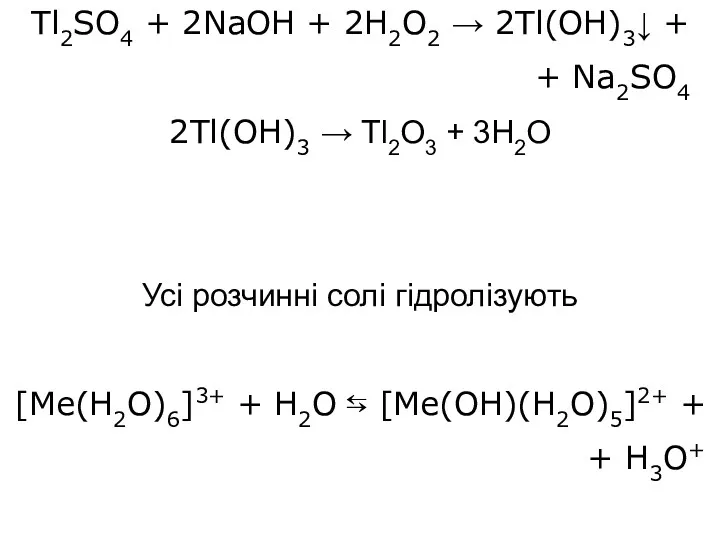
- 33. Tl2SO4 + 2NaOH + 2H2O2 → 2Tl(OH)3↓ + + Na2SO4 2Tl(OH)3 → Tl2O3 + 3H2O Усі
- 34. Сполуки з гідрогеном 4LiH + MeCl3 → Li[MeH4] + 3LiCl GaH4 InH4 TlH4 стійкість зменшується -
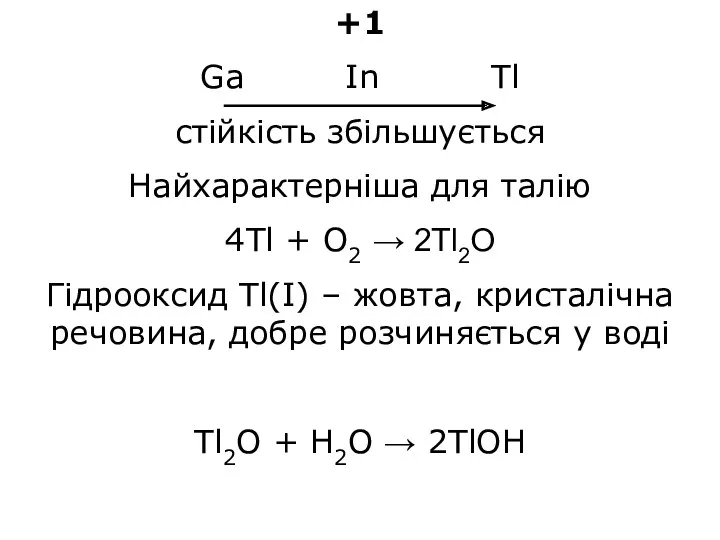
- 35. +1 Ga In Tl стійкість збільшується Найхарактерніша для талію 4Tl + O2 → 2Tl2O Гідрооксид Tl(I)
- 36. 2TlOH + CO2 → Tl2CO3 + H2O Tl2CO3 + CO2 + H2O → 2Tl(HCO3) Більшість солей
- 37. Застосування Серед металів Al посідає друге місце після заліза за обсягами використання Щорічно в світі видобувають
- 38. Al застосовують в алюмотермії для добування металів і виготовлення фольги для конденсаторів, у харчовій промисловості Порошок
- 39. Серед сполук алюмінію найширше використовують сульфат алюмінію: для проклеювання паперу, “білого” дублення шкіри, протравлювання тканин перед
- 40. α – Al2O3 у вигляді корунду використовують як абразив, а Υ -Al2O3 – як ефективний сорбент
- 41. Ga, In і Tl поки що не знаходять широкого застосування внаслідок їх малої доступності і великої
- 42. Індій – для створення антикорозійних покрить, стійких до лугів у виробництві рідкокристалічних панелей, фотоелементів, інфрачервоних детекторів
- 44. Скачать презентацию

![Добування 3Na2CO3 + 2Al(OH)3 + 12HF → 2Na3[AlF6] + 3CO2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581443/slide-2.jpg)



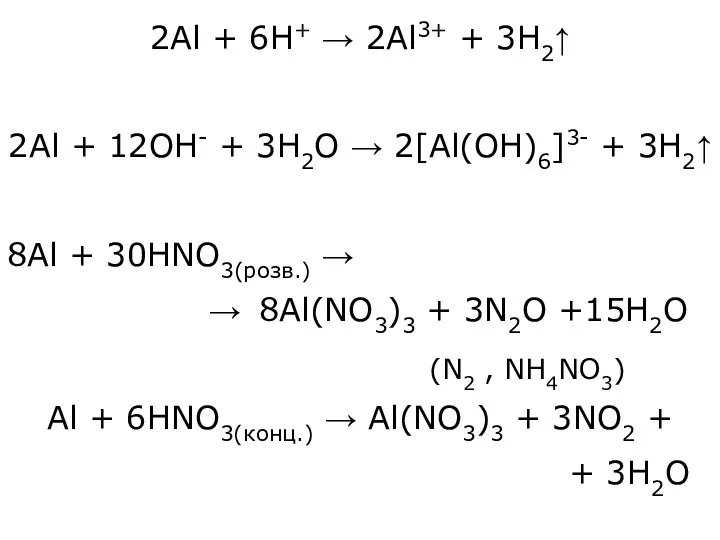






![[Al(H2O)6]3+ ⇄ [Al (OH)3(H2O)3] ⇄ [Al(OH)6]3- Кислотні й основні властивості](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581443/slide-16.jpg)
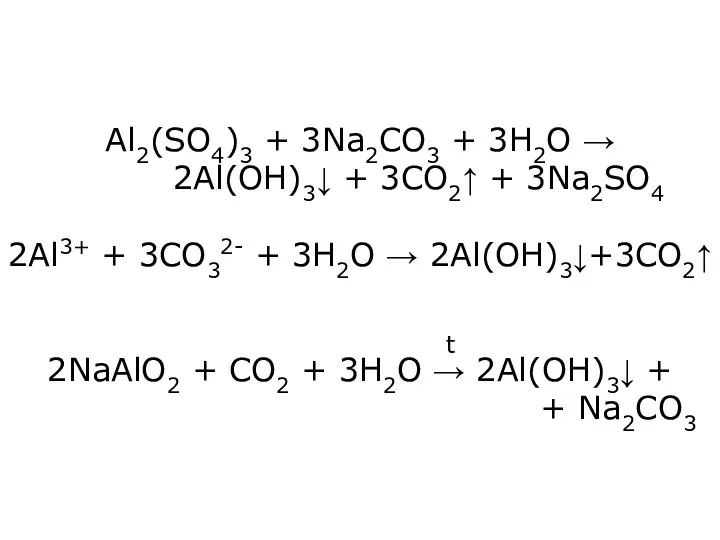
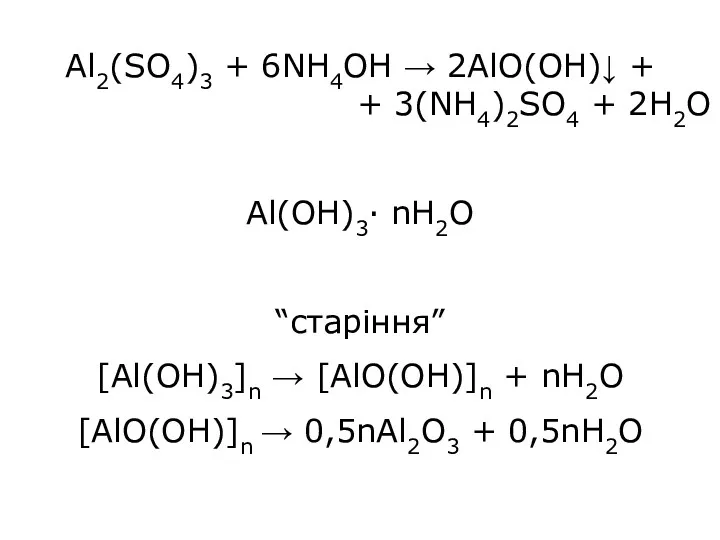
![[Al(H2O)6]3+ + H2O ⇆ [AlOH(H2O)5]2+ + H3O+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581443/slide-21.jpg)
![[Al(H2O)6]3+ + H2O⇆ [AlOH(H2O)5]2+ + H3O+ K = 1·10-5 [AlOH(H2O)5]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581443/slide-22.jpg)





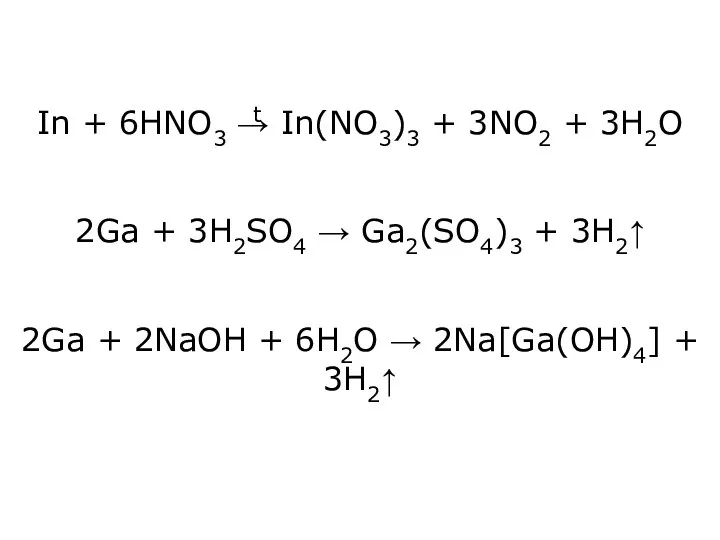

![Сполуки з гідрогеном 4LiH + MeCl3 → Li[MeH4] + 3LiCl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/581443/slide-33.jpg)







 Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Первичная переработка нефти
Первичная переработка нефти Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Электронные конфигурации атомов
Электронные конфигурации атомов Нефть. Свойства нефти
Нефть. Свойства нефти Строение атома углерода
Строение атома углерода Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Применение серной кислоты
Применение серной кислоты Гигиена питания школьников
Гигиена питания школьников Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Жасыл химия
Жасыл химия Стратегия химической промышленности
Стратегия химической промышленности Коррозия металлов
Коррозия металлов XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023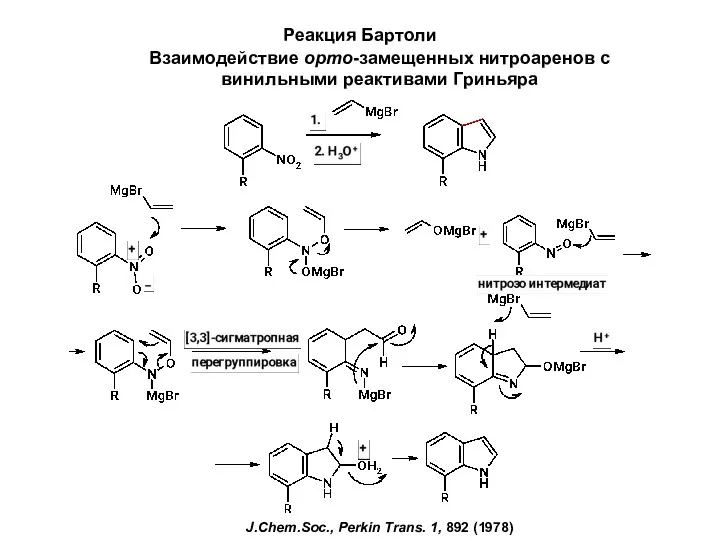 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Методы в химии
Методы в химии Синтетические органические вещества
Синтетические органические вещества Качественные реакции на органические вещества
Качественные реакции на органические вещества Жиры
Жиры