Содержание
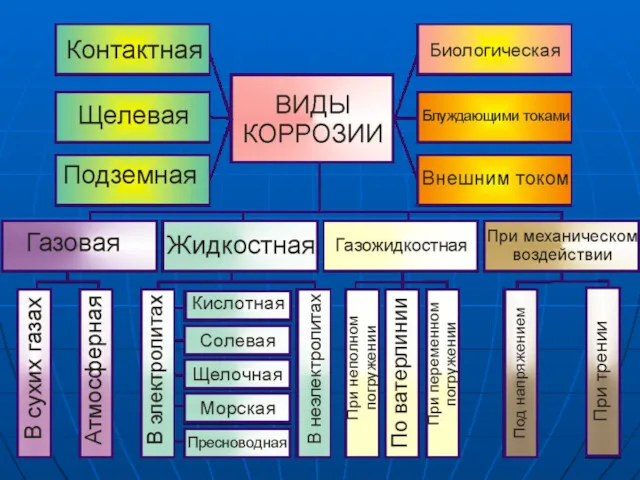
- 2. Разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются
- 4. ХИМИЧЕСКАЯ КОРРОЗИЯ Данная коррозия протекает в среде окислительного газа при повышенных температурах или в жидких неэлектролитах.
- 5. 4 Fe + 3 O2 = 2 Fe2O3 К химической коррозии относятся процессы взаимодействия металлов с
- 6. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Скорость такой
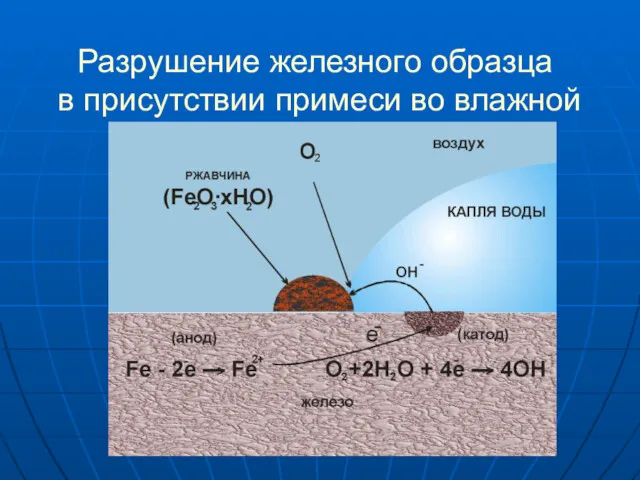
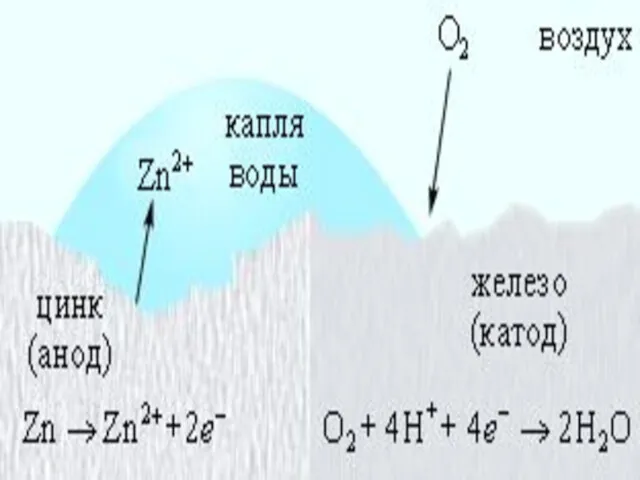
- 7. Разрушение железного образца в присутствии примеси во влажной среде
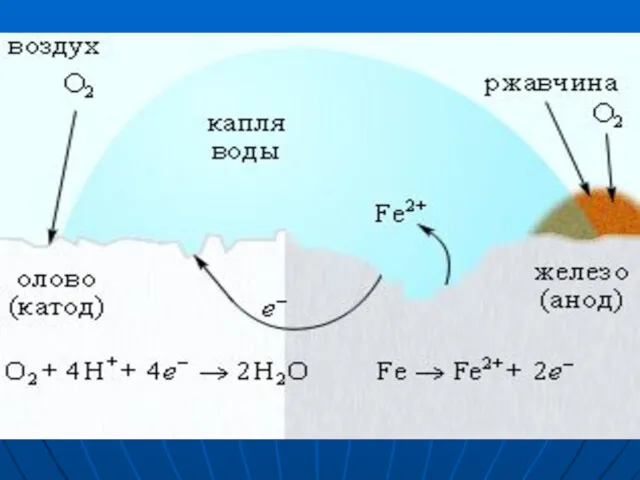
- 8. На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и
- 9. Поток электронов перемещается к катодному участку (примесь) с меньшей активностью, на нем накапливается избыточное количество электронов.
- 10. Далее катионы Fe2+ и гидроксид-ионы соединяются. Образуется гидроксид железа(II), который в присутствии кислорода и воды переходит
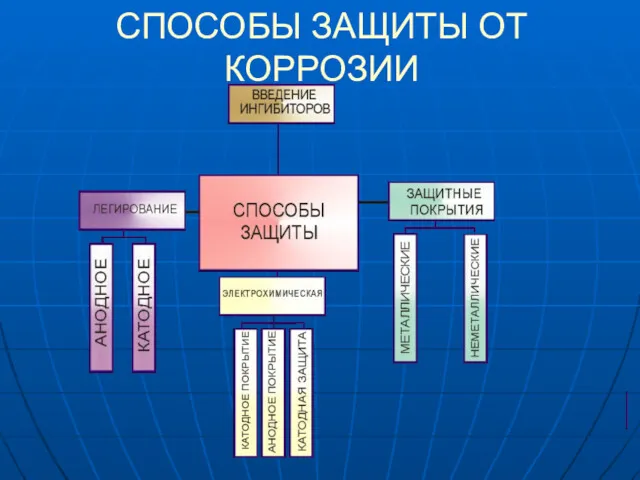
- 11. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
- 12. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА КАТОДНЫЕ ПОКРЫТИЯ покрытия менее активными металлами более активных, например, Sn на Fe (луженое железо).
- 14. АНОДНЫЕ ПОКРЫТИЯ покрытия более активными металлами менее активных, например, Zn на Fe (оцинкованное железо). При повреждении
- 16. КАТОДНАЯ ЗАЩИТА Конструкция подключается к отрицательному полюсу постоянного тока. Используется в сочетании с лакокрасочными и другими
- 18. ПРОТЕКТОРНАЯ ЗАЩИТА К защищаемому металлу присоединяется большой образец другого, более активного металла, выполняющего роль анода и
- 19. Протектор
- 21. Скачать презентацию













 Водород. Сущность водорода как химического элемента
Водород. Сущность водорода как химического элемента Этиловый спирт в жизни человека
Этиловый спирт в жизни человека Целлюлоза
Целлюлоза Введение в органическую химию
Введение в органическую химию 20230419_azot
20230419_azot Иондық байланыс
Иондық байланыс Поверхностные явления
Поверхностные явления Основания
Основания Камни и Лев
Камни и Лев Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Валентность и степень окисления 8 класс
Валентность и степень окисления 8 класс Менделеевские уроки. День науки
Менделеевские уроки. День науки Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Электролиз. 11 класс
Электролиз. 11 класс Ртуть. Использование ртути
Ртуть. Использование ртути Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4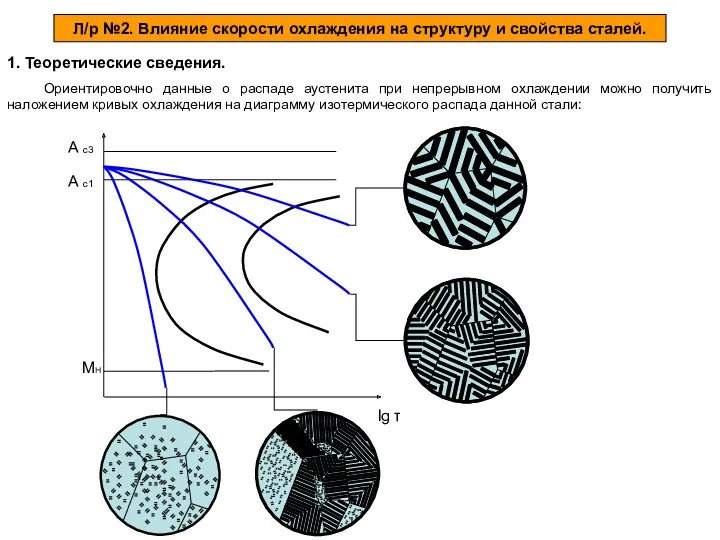 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Спирти. Феноли. Етери
Спирти. Феноли. Етери Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Строение и физические свойства металлов
Строение и физические свойства металлов 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Альдегиды и кетоны
Альдегиды и кетоны Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Водно-солевой режим оборотной системы. Эффективность использования воды. Коэффициент концентрирования солей
Водно-солевой режим оборотной системы. Эффективность использования воды. Коэффициент концентрирования солей