Содержание
- 2. Модуль 3. Основные конструкционные материалы. Слайд 8.01
- 3. Коррозия с кислородной деполяризацией и определяется диффузией кислорода. Т.к. растворимость кислорода, особенно в концентрированных кислотах не
- 4. Коррозия меди в кислых средах Из наиболее применяемых кислот наиболее нестойка медь в азотной кислоте, так
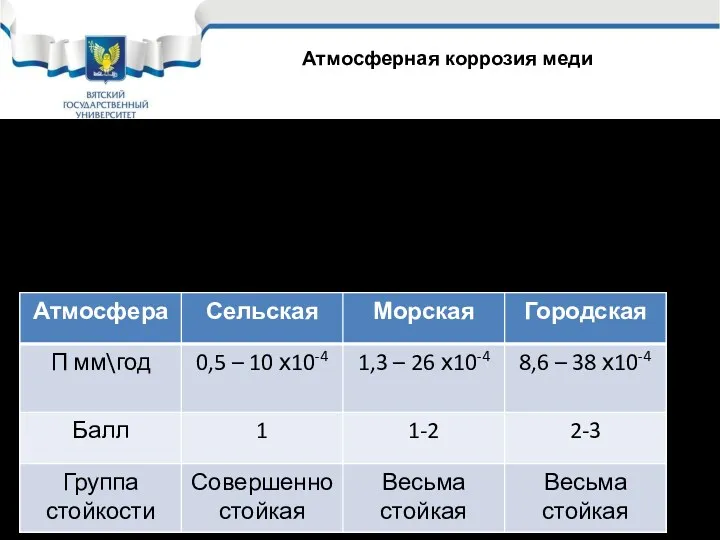
- 5. Атмосферная коррозия меди Скорость коррозии меди в атмосфере в основном равномерная и уменьшается во времени. Медь
- 6. Далее в результате окисления сульфида в продуктах коррозии появляется сульфат меди, гидролиз его приводит к образованию
- 7. Повышенная атмосферная коррозия наблюдается: При сильных локальных загрязнениях SO2 и сероводородом. При постоянной конденсации влаги вблизи
- 8. Подводная коррозия меди Медь устойчива в воде за счет образования пленок сложного состава. И поэтому широко
- 9. Общая коррозия меди в почвах невелика, но колеблется в широких пределах от 0,5 – 355 х10-4
- 10. Химическое сопротивление меди Таким образом, медь не стойка В азотной и концентрированной серной кислоте В NH4OH
- 11. Химическое сопротивление латуней Латуни за счет появления в их составе цинка более химически активны, чем медь
- 12. Высокопрочные сплавы Al с цинком наименее устойчивы. Подвержены межкристаллитной, питтинговой, расслаивающей коррозии и коррозионному растрескиванию. Дюралюминий,
- 14. Скачать презентацию










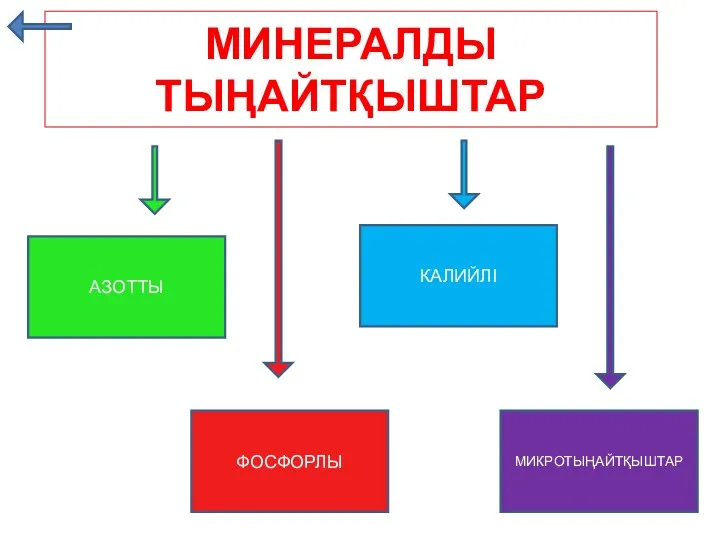 Минералды тыңайтқыштар
Минералды тыңайтқыштар Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Пены. Пенообразование
Пены. Пенообразование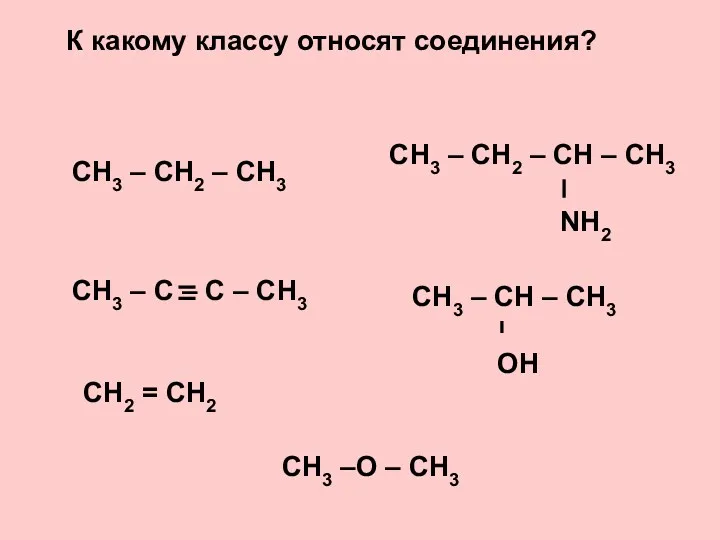 16_OP_05_Alkany
16_OP_05_Alkany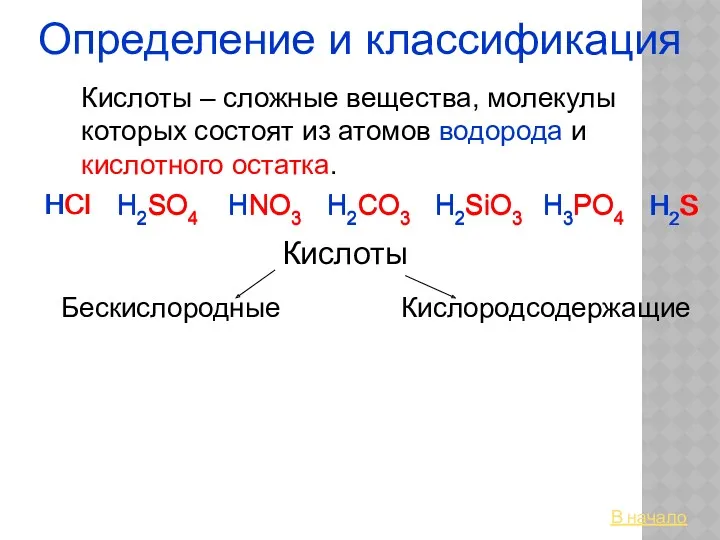 Кислоты. Определение и классификация
Кислоты. Определение и классификация Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов d-элементы
d-элементы Химия и живопись
Химия и живопись Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическое равновесие
Химическое равновесие Тест: полимеры
Тест: полимеры Платина. Физические и химические свойства
Платина. Физические и химические свойства Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Химические реакции
Химические реакции Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Гідроліз солей
Гідроліз солей Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Соединения железа. Охарактеризуйте Fe
Соединения железа. Охарактеризуйте Fe Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Водород
Водород Композиционные материалы
Композиционные материалы Реакции ионного обмена
Реакции ионного обмена Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1