Содержание
- 2. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ.
- 3. Конденсированные гетероциклические соединения
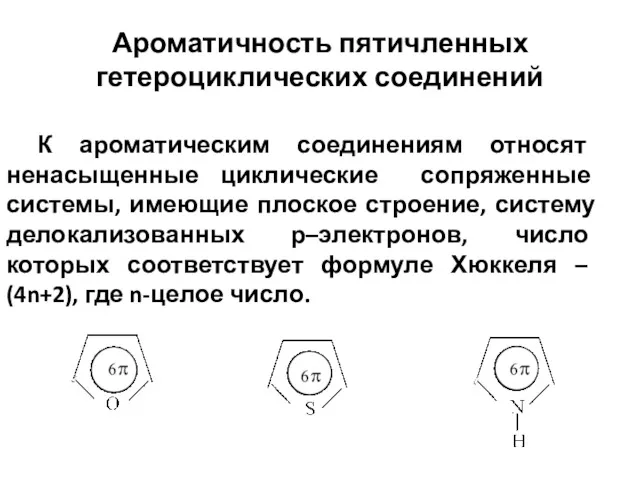
- 4. Ароматичность пятичленных гетероциклических соединений К ароматическим соединениям относят ненасыщенные циклические сопряженные системы, имеющие плоское строение, систему
- 5. Вследствие участия электронной пары гетероатомов в общей системе сопряжения в тиофене, фуране, пирроле имеет место достаточно
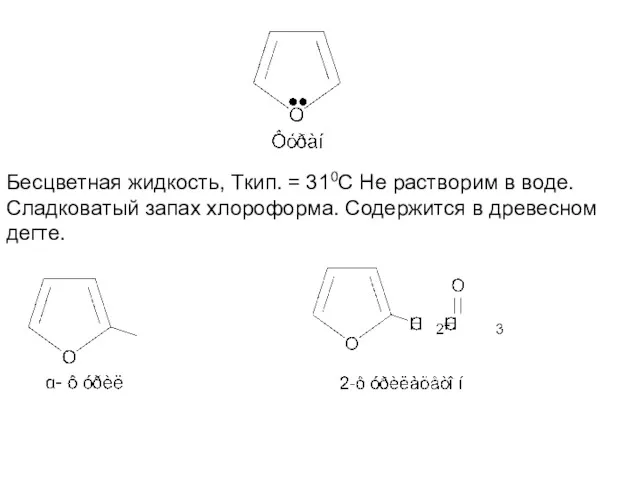
- 6. Бесцветная жидкость, Ткип. = 310С Не растворим в воде. Сладковатый запах хлороформа. Содержится в древесном дегте.
- 7. Способы получения фурана:
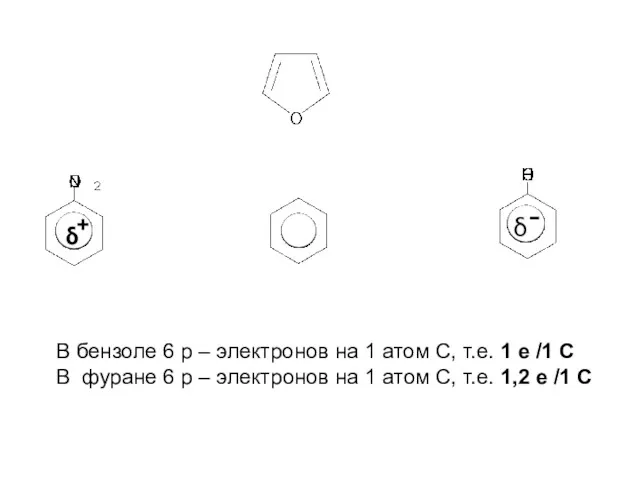
- 8. В бензоле 6 p – электронов на 1 атом С, т.е. 1 e /1 C В
- 9. Реакции электрофильного замещения в тиофене, фуране, пирроле
- 10. Химические свойства фурана. 1. Реакция сульфирования фурана 2. Реакция нитрования фурана
- 11. 3. Ацилирование фурана по Фриделю-Крафтсу 4. Реакция Дильса-Альдера
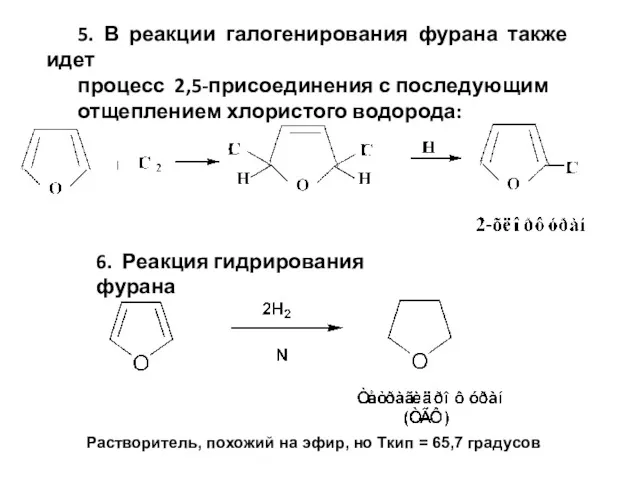
- 12. 5. В реакции галогенирования фурана также идет процесс 2,5-присоединения с последующим отщеплением хлористого водорода: 6. Реакция
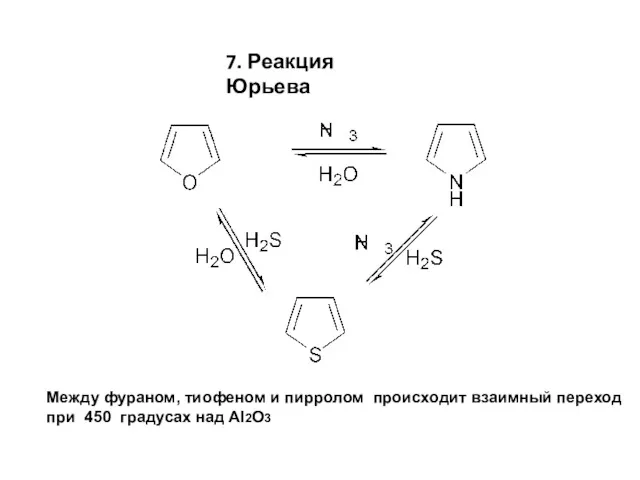
- 13. 7. Реакция Юрьева Между фураном, тиофеном и пирролом происходит взаимный переход при 450 градусах над Al2O3
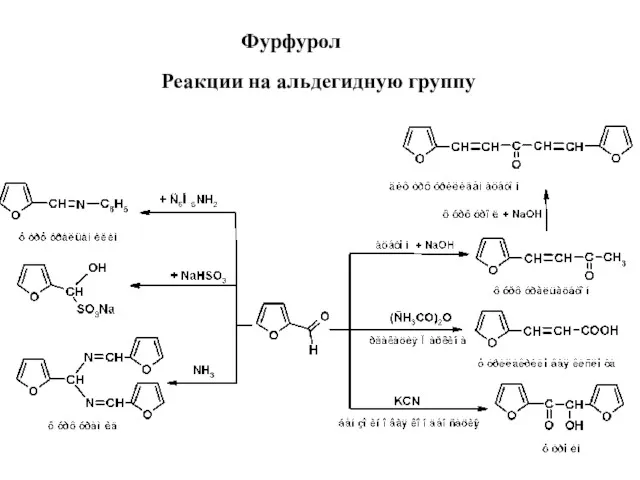
- 14. Фурфурол Реакции на альдегидную группу
- 15. Лекарства на основе фурана Фурациллин, семикарбазон 5-нитрофурфурола, противомикробное средство Фуросемид, диуретическое средство
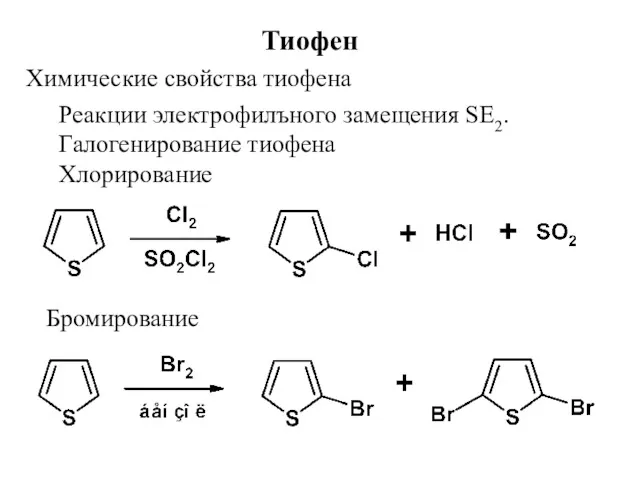
- 16. Тиофен Химические свойства тиофена Реакции электрофилъного замещения SE2. Галогенирование тиофена Хлорирование Бромирование
- 17. Сульфирование Тиофен Нитрование
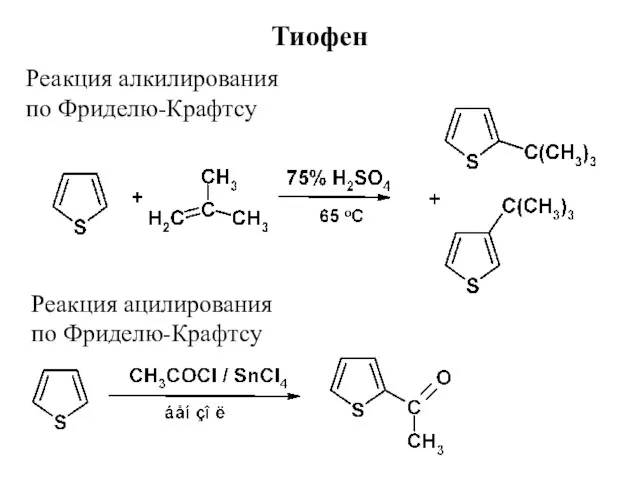
- 18. Реакция алкилирования по Фриделю-Крафтсу Тиофен Реакция ацилирования по Фриделю-Крафтсу
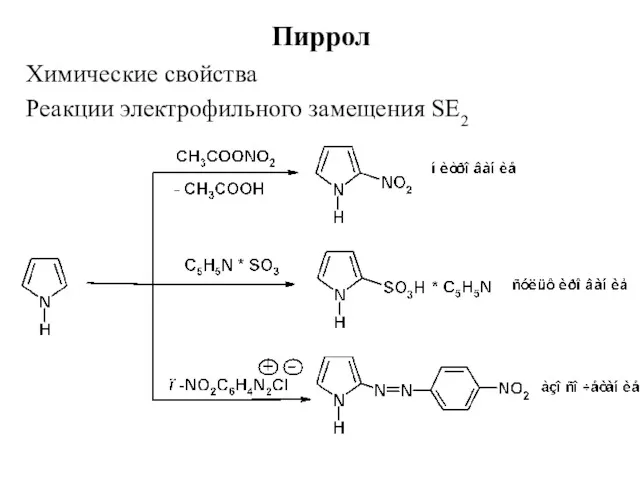
- 19. Пиррол Химические свойства Реакции электрофильного замещения SE2
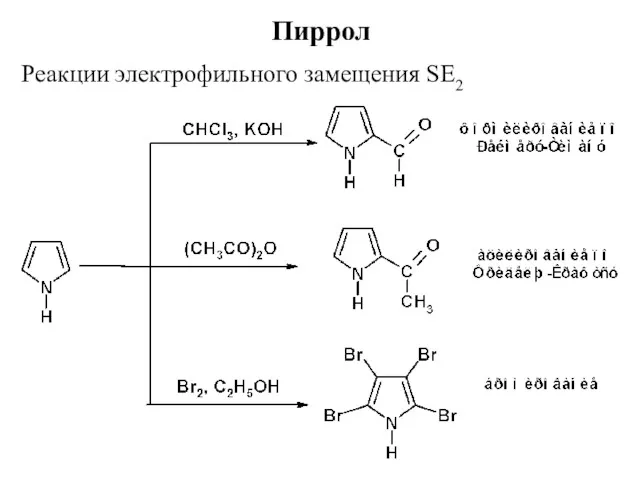
- 20. Пиррол Реакции электрофильного замещения SE2
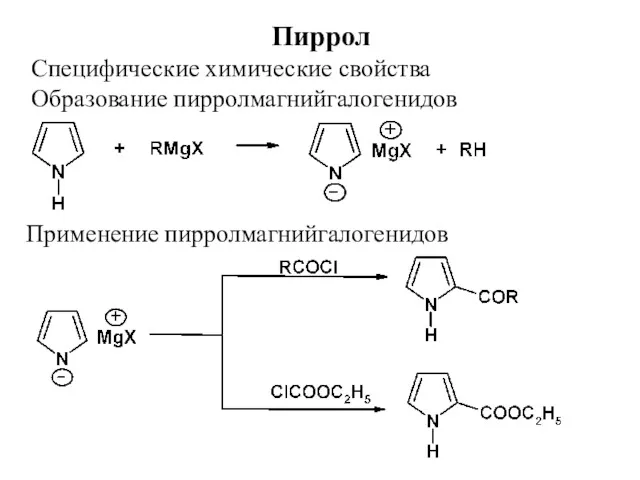
- 21. Пиррол Специфические химические свойства Образование пирролмагнийгалогенидов Применение пирролмагнийгалогенидов
- 22. Порфин
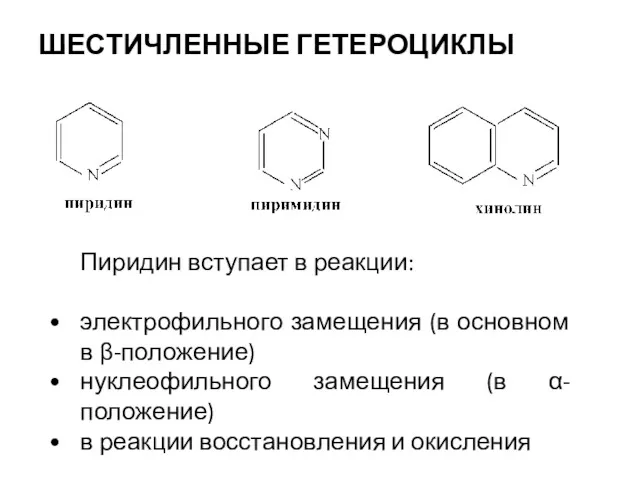
- 23. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ Пиридин вступает в реакции: электрофильного замещения (в основном в β-положение) нуклеофильного замещения (в α-положение)
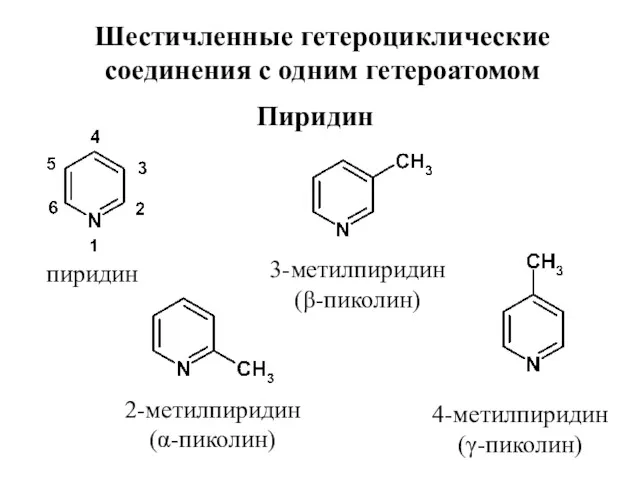
- 24. Шестичленные гетероциклические соединения с одним гетероатомом Пиридин пиридин 2-метилпиридин (α-пиколин) 3-метилпиридин (β-пиколин) 4-метилпиридин (γ-пиколин)
- 25. Ароматичность пиридина
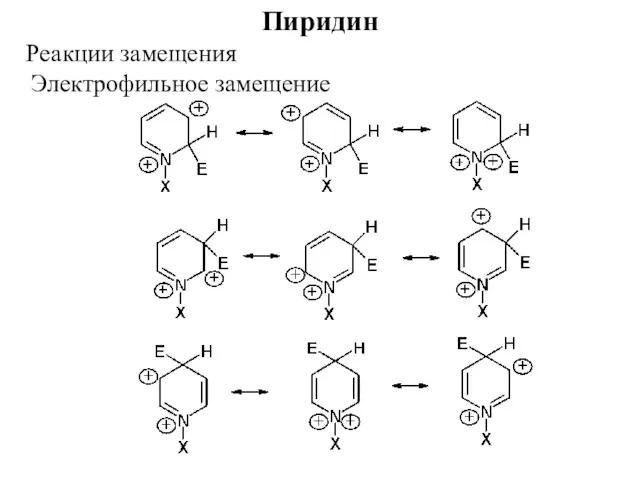
- 26. Пиридин Реакции замещения Электрофильное замещение
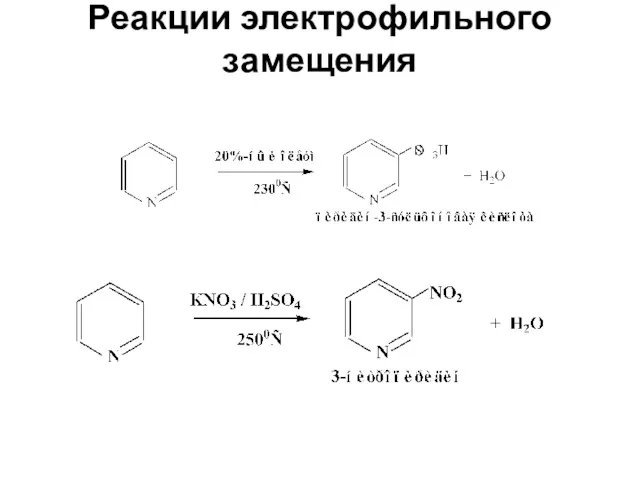
- 27. Реакции электрофильного замещения
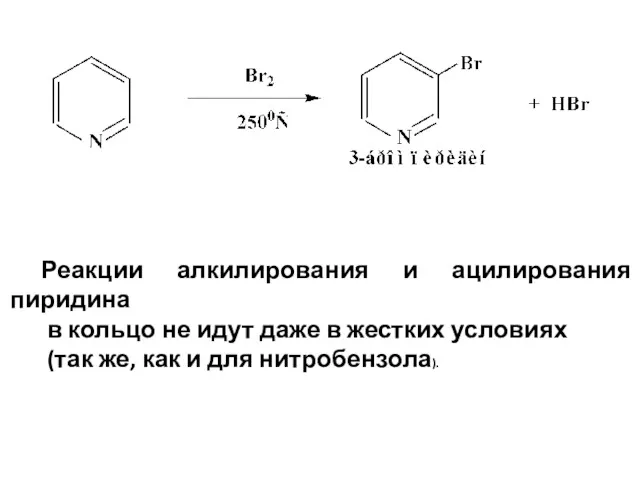
- 28. Реакции алкилирования и ацилирования пиридина в кольцо не идут даже в жестких условиях (так же, как
- 29. Реакции нуклеофильного замещения (реакция Чичибабина)
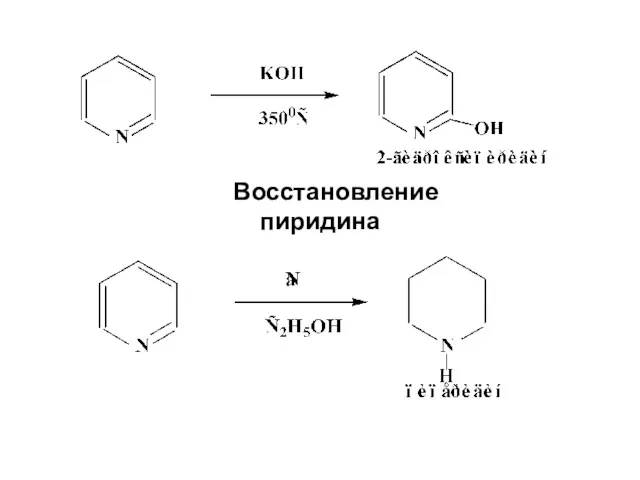
- 30. Восстановление пиридина
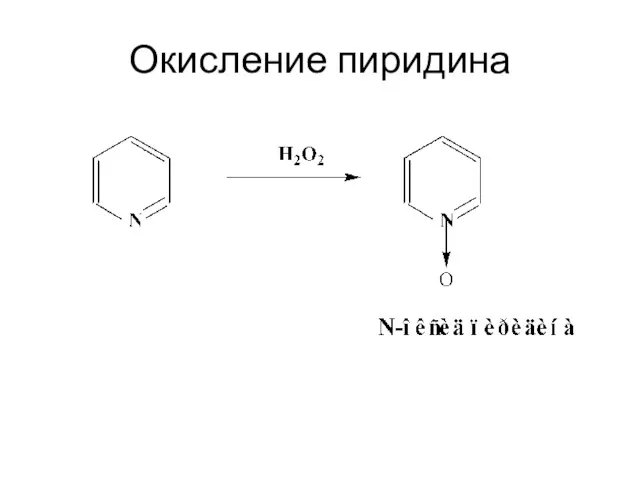
- 31. Окисление пиридина
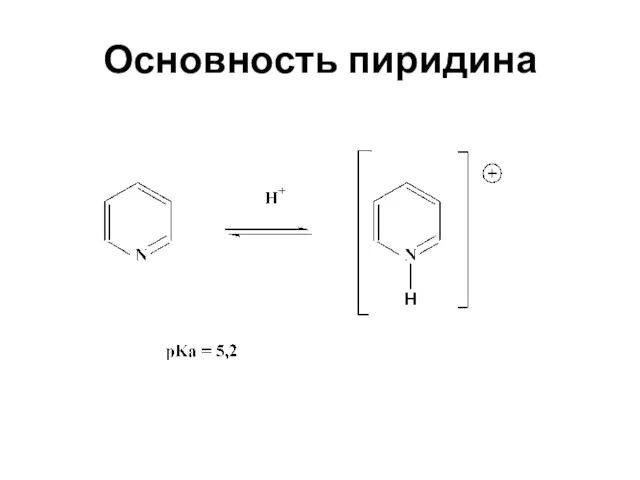
- 32. Основность пиридина
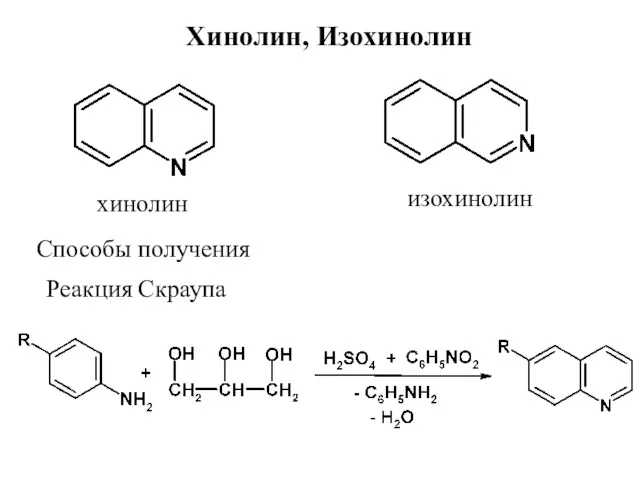
- 33. Хинолин, Изохинолин хинолин изохинолин Способы получения Реакция Скраупа
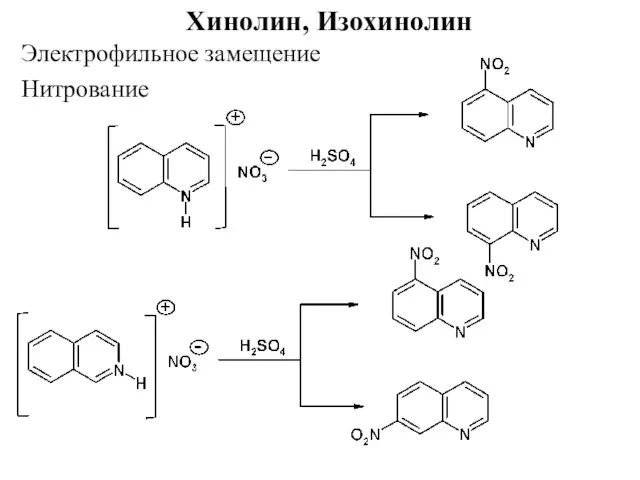
- 34. Хинолин, Изохинолин Нитрование Электрофильное замещение
- 35. Хинолин, Изохинолин Окисление
- 37. Скачать презентацию













 Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Бутадиеновые каучуки
Бутадиеновые каучуки Общая характеристика авиационных материалов, тенденции их развития
Общая характеристика авиационных материалов, тенденции их развития Водород
Водород Азотная кислота
Азотная кислота Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Альдегиды и карбоновые кислоты
Альдегиды и карбоновые кислоты Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Алкадиены
Алкадиены Атомы химических элементов
Атомы химических элементов Спирти. Історична довідка
Спирти. Історична довідка Минералогия литофильных редких элементов. Цирконий и гафний
Минералогия литофильных редких элементов. Цирконий и гафний Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Additives for Polymeric Materials
Additives for Polymeric Materials Ионная химическая связь
Ионная химическая связь Основные свойства и механизмы упрочнения КМ
Основные свойства и механизмы упрочнения КМ Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров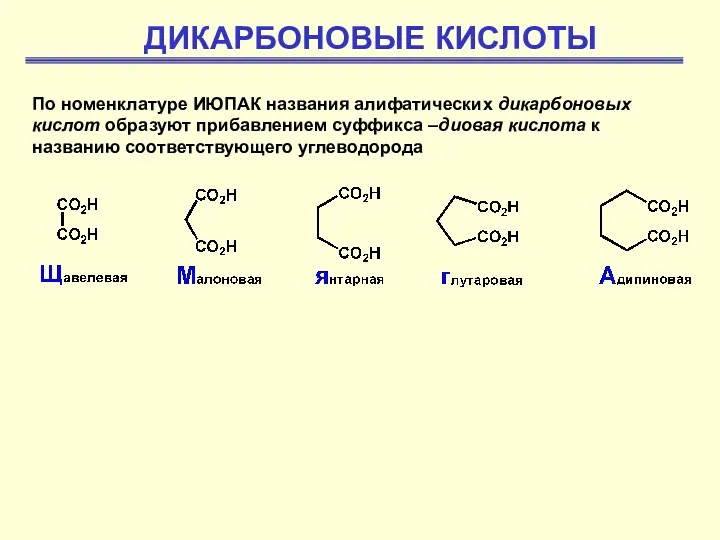 Дикарбоновые кислоты
Дикарбоновые кислоты Мыла и синтетические моющие средства
Мыла и синтетические моющие средства ПВХ
ПВХ Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Азот и его соединения. Повторение
Азот и его соединения. Повторение Значення хімічних процесів у природі
Значення хімічних процесів у природі Органічні розчинники
Органічні розчинники Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Расчеты по химическим уравнениям. 8 класс
Расчеты по химическим уравнениям. 8 класс Механические свойства минералов
Механические свойства минералов