Содержание
- 2. История Ртуть – 1 из 7 металлов древности. Она известна более 1500 лет до н.э. в
- 3. Народам Индии и Китая самородная ртуть была известна за 2000 лет до н. э. Ими же,
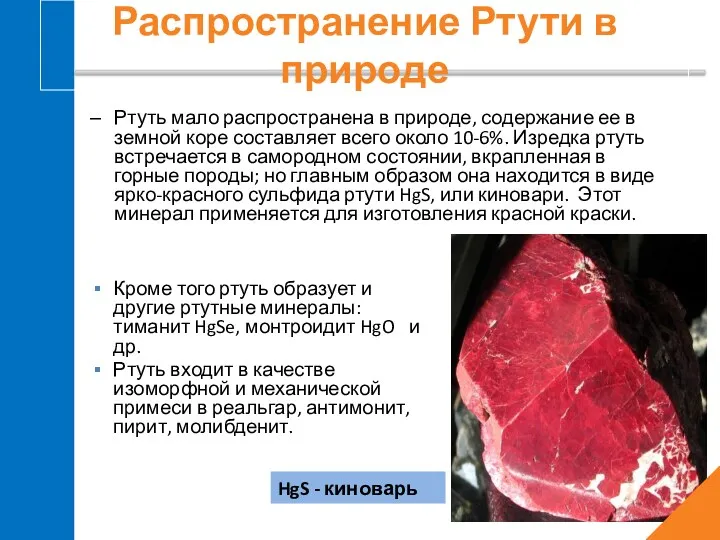
- 4. Распространение Ртути в природе Ртуть принадлежит к числу весьма редких элементов. Приблизительно в таких количествах она
- 5. Ртуть мало распространена в природе, содержание ее в земной коре составляет всего около 10-6%. Изредка ртуть
- 6. Самородная ртуть Hg Ртуть на киноварь-кварцевом агрегате. Levigliani, Тоскана, Италия Ртуть на барите. Шахта Анна, Зигерланд,
- 7. Каломель (Hg2)2+(Cl,Br)2 Терлингуа, Техас San-Onofre. Мексика Авала, Сербия
- 8. Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
- 9. Химический элемент Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого периода периодической системы химических элементов Д.
- 10. Физические свойства Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость,
- 11. Физические свойства Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C). Обладает
- 12. Химические свойства Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть
- 13. Химические свойства Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами,
- 14. Химические свойства Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути: При
- 15. Химические свойства При нагревании до 300 °C ртуть вступает в реакцию с кислородом: При этом образуется
- 16. Химические свойства При нагревании ртути с серой образуется сульфид ртути(II): Сульфид ртути Реакция демеркуризации
- 17. Химические свойства Ртуть также реагирует с галогенами (причём на холоде — медленно). Ртуть можно окислить также
- 18. Получение Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом: Пары ртути конденсируют и собирают. Этот
- 19. Ртуть широко применяется при изготовлении научных приборов:(барометры, термометры, манометры, вакуумные насосы и др.), в ртутных лампах,
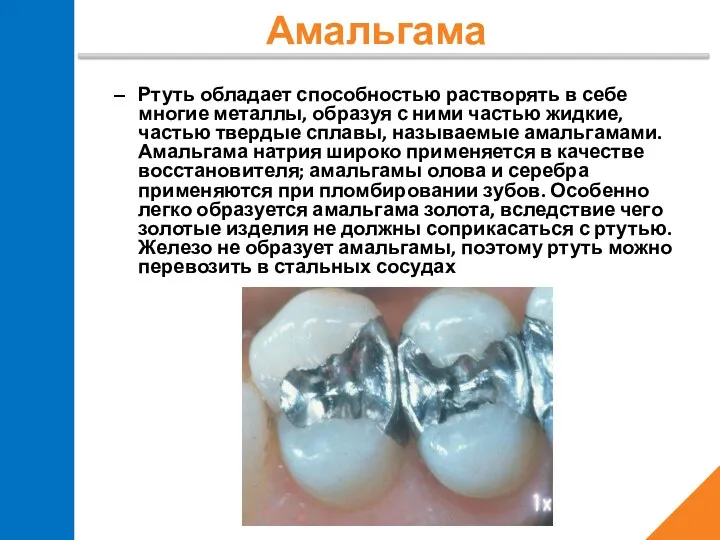
- 20. Ртуть обладает способностью растворять в себе многие металлы, образуя с ними частью жидкие, частью твердые сплавы,
- 21. Соединения ртути Оксид ртути(II) — HgO Это твёрдое непрочное при нормальных условиях вещество красного или оранжевого
- 22. Соединения ртути Фульминат ртути(II) Hg(ONC)2 («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы). «Гремучую ртуть»
- 23. Соединения ртути Сулема - хлорид ртути HgCl2 был первым веществом на основе Hg, которое начали использовать
- 24. Соединения ртути Ка́ломель, хлористая ртуть, хлорид одновалентной ртути Hg2Cl2 - бесцветные, мало растворимые в воде кристаллы.
- 25. Соединения ртути Циани́д рту́ти(II) Hg(CN)2 — неорганическое соединение, ртутная соль синильной кислоты. Содержит 79% ртути. Белое
- 26. Безобидная, на первый взгляд, капля, но в ней таится большая опасность
- 27. Основной опасность представляют пары металлической ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха.
- 28. Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что
- 29. Домашнее задание: П.18, стр. 244-245, №30
- 31. Скачать презентацию


























 Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Фосфор красный, белый и черный
Фосфор красный, белый и черный Переработка угля
Переработка угля Виды химических реакций
Виды химических реакций Супрамолекулярний контроль для дослідження реакційної здатності та каталізу
Супрамолекулярний контроль для дослідження реакційної здатності та каталізу Алкени і алкіни
Алкени і алкіни Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Дисперсные системы
Дисперсные системы Азот и его соединения. Повторение
Азот и его соединения. Повторение Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз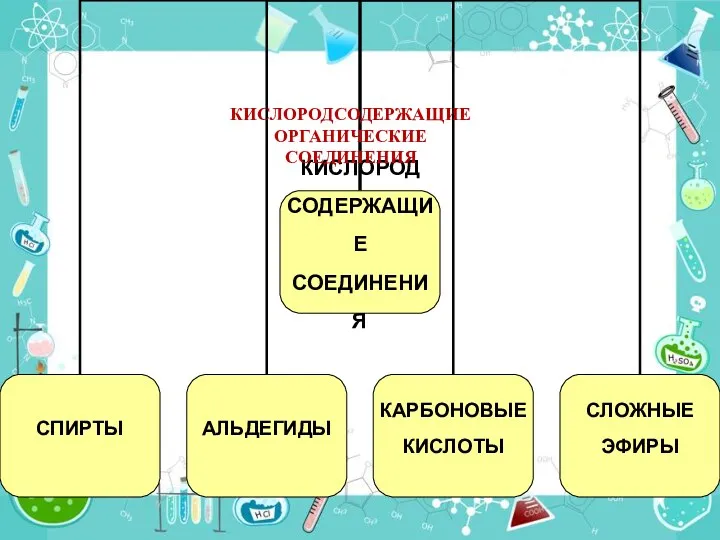 Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Водород
Водород Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Защита металлов от коррозии
Защита металлов от коррозии Решение комбинированных задач. Задачи на смеси
Решение комбинированных задач. Задачи на смеси Аммиак. Соли аммония
Аммиак. Соли аммония Apparatus of installations with circulating ball catalyst
Apparatus of installations with circulating ball catalyst Циклоалканы
Циклоалканы Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Электролитическая диссоциация
Электролитическая диссоциация Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222)