Слайд 2

Алгоритм составления уравнений химических реакций
1. В левой части записываются формулы веществ,
которые вступают в реакцию: KOH + CuCl2 →.
2. В правой части (после стрелки) – формулы веществ, которые получаются в результате реакции:
KOH + CuCl2 → Cu(OH)2 + KCl.
3. Затем с помощью коэффициентов уравнивается число атомов одинаковых химических элементов в правой и левой частях уравнения :
2KOH + CuCl2 = Cu(OH)2 + 2KCl.
Слайд 3

Основные правила расстановки коэффициентов
Расстановку коэффициентов начинают с элемента, чьих атомов в
реакции участвует больше.
Количество атомов кислорода до и после реакции в большинстве случаев должно быть четным.
Если в реакции (обмена) участвуют сложные вещества, то расстановку коэффициентов начинают с атомов металлов или с кислотных остатков.
Слайд 4
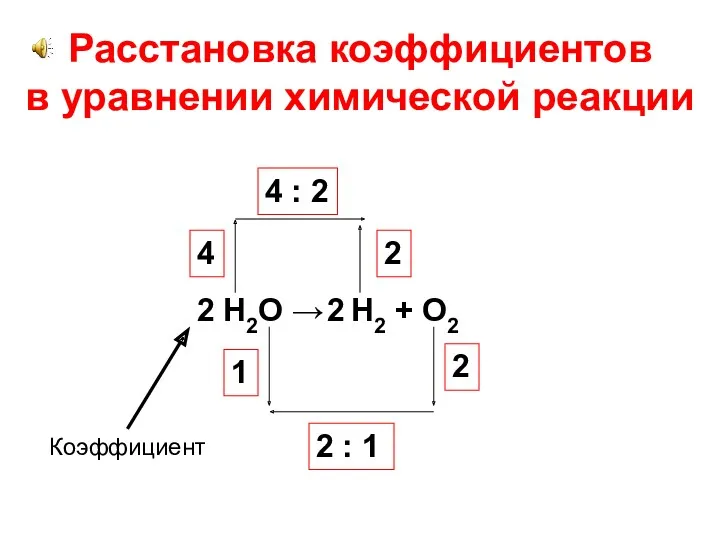
Н2О → Н2 + О2
Расстановка коэффициентов
в уравнении химической реакции
4
4 : 2
2
2
1
2 : 1
2
2
Коэффициент
Слайд 5

Что показывает химическое уравнение
Какие вещества вступают в реакцию.
Какие вещества образуются в
результате реакции.
Массу реагирующих веществ и веществ, образующихся в результате химической реакции.
Отношение масс реагирующих веществ и веществ, образующихся в результате химической реакции.




 Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Photocatalysts based on AgCl / Ag nanocomposites
Photocatalysts based on AgCl / Ag nanocomposites Альдегиды и кетоны
Альдегиды и кетоны Спирты: общая характеристика
Спирты: общая характеристика Материаловедение в полиграфическом и упаковочном производстве
Материаловедение в полиграфическом и упаковочном производстве B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства
Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства Основания
Основания Кислород. Атом кислорода
Кислород. Атом кислорода Простые и сложные эфиры
Простые и сложные эфиры Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Альдегиды и кетоны
Альдегиды и кетоны Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Химическая технология органических веществ
Химическая технология органических веществ Сложные эфиры. Жиры
Сложные эфиры. Жиры Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Классификация химических реакций
Классификация химических реакций Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда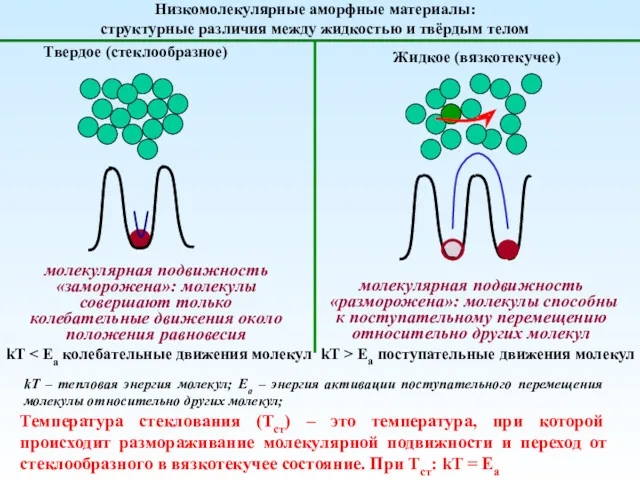 Механика полимеров
Механика полимеров Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Механические свойства минералов
Механические свойства минералов Строение атома
Строение атома Геохимия, как наука
Геохимия, как наука Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров