Содержание
- 2. Основания- сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
- 3. Общая формула оснований: Ме(ОН)n, Где Ме - металл n-число гидроксогрупп и одновременно валентность металла.
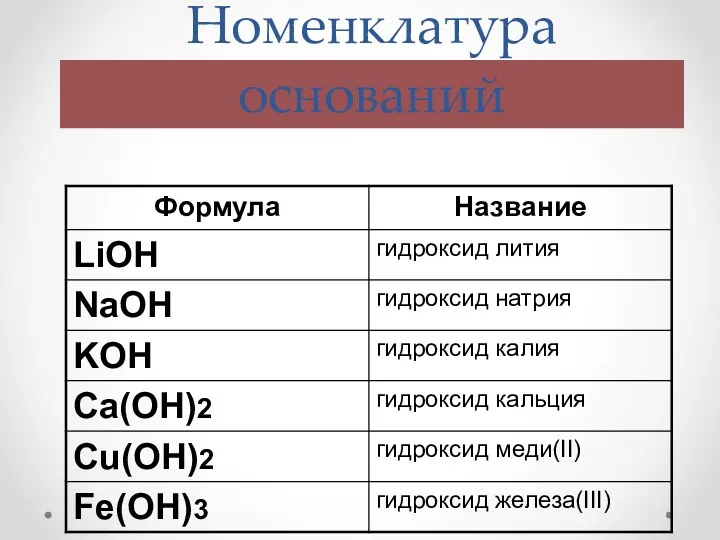
- 4. Номенклатура оснований Название оснований= Гидроксид + название металла в родительном падеже + валентность римскими цифрами (переменная)
- 5. Номенклатура оснований
- 6. Дайте названия гидроксидам: Ba(OH)2 Fe(OH)2 Al(OH)3 NaOH
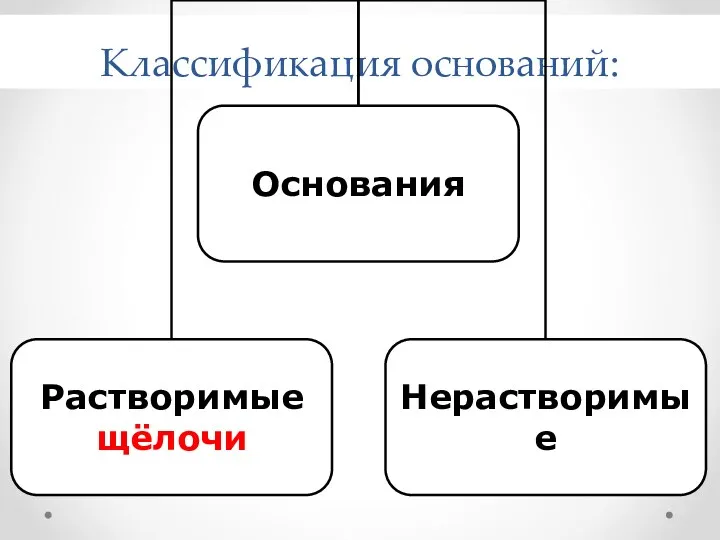
- 7. Классификация оснований:
- 8. Классификация оснований Растворимые в воде (щелочи) Нерастворимые в воде NaOH Ca(OH)2 Fe(OH)3 Сu(OH)2
- 9. Определите к какой группе относятся соединения NaOH, Mg(OH)2, RbOH, Ba(OH)2, Ni(OH)2, Cu(OH)2, Cr(OH)3
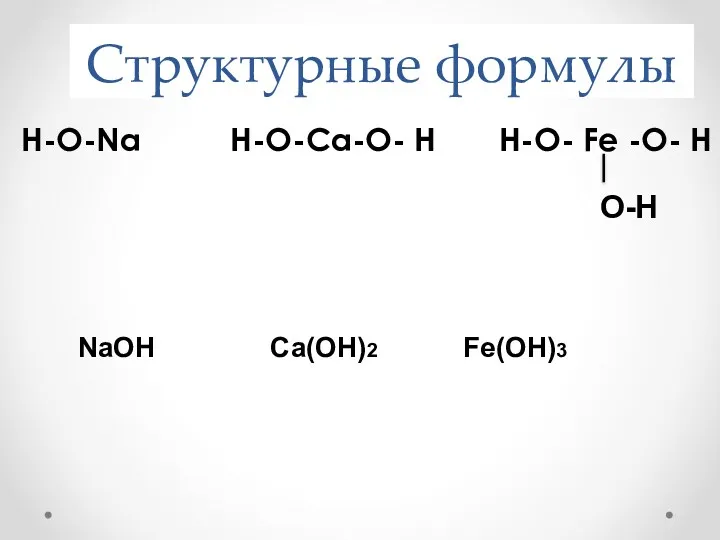
- 10. Структурные формулы Н-О-Na Н-О-Ca-О- Н Н-О- Fe -О- Н NaOH Ca(OH)2 Fe(OH)3 O-H
- 11. Физические свойства Основания - твердые кристаллические вещества. Отношение к воде- Цвет
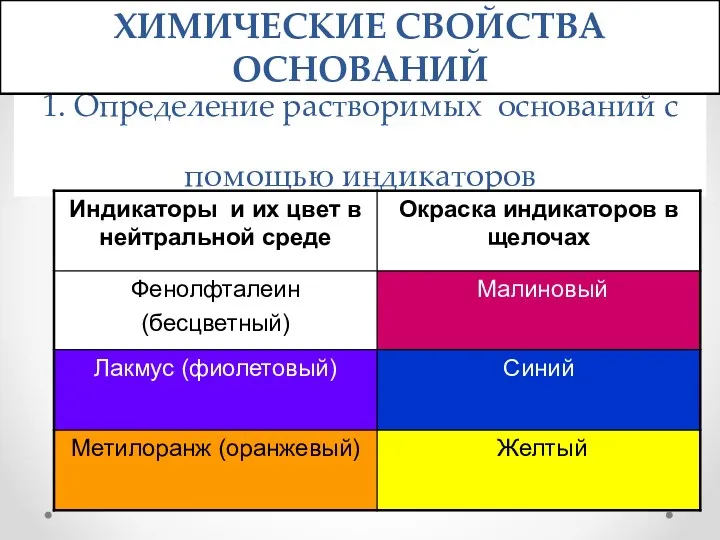
- 12. 1. Определение растворимых оснований с помощью индикаторов ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 14. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 2.Взаимодействие с кислотами Основание+кислота=соль+вода KOH+HCl=KCl+H2O Cu(OH)2+2HCl=CuCl2+2H2O
- 15. Взаимодействие с кислотами: 2NaOH + H2SO4 → Na2SO4 + 2H2O реакция нейтрализации
- 16. Cu(OH)2↓+ H2SO4 →…+…
- 17. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 3.Взаимодействие с кислотными оксидами Щелочь + кислотный оксид=соль+вода 2KOH+CO2=K2CO3+H2O
- 18. Взаимодействие с кислотными оксидами Са(ОН)2 + СО2 → …+ … реакция обмена
- 19. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 4.Взаимодействие с амфотерными оксидами Щелочь+ амфотерный оксид=соль+вода 2KOH+ZnO=K2ZnO2+H2O
- 20. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание!!! Щелочь+соль1= нерастворимое основание
- 21. CuSO4 + NaOH→…+ … FeCl3 + NaOH→…+ …
- 22. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 6.При нагревании разлагаются нерастворимые основания (кроме LiOH): Cu (OH)2 = CuO+H2O Только для
- 23. Отношение оснований к нагреванию Fe(OH)2 → …+ … t
- 24. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 7. Амфотерные гидроксиды Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие взаимодействуют с кислотами Zn
- 25. Задание Не является щёлочью : 1)NaOH; 2)Ca(OH)2; 3)Mg(OH)2; 4)KOH.
- 26. Вопросы Что такое основание? Классификация Щелочь-это Номенклатура Химические свойства щелочей и нерастворимых оснований Способы получения оснований
- 31. Тест 1. Формулы только оснований приведены в ряду 1) Na2CO3, NaOH, NaCl 3) KОН, Mg(OH)2, Cu(OH)2
- 33. Скачать презентацию










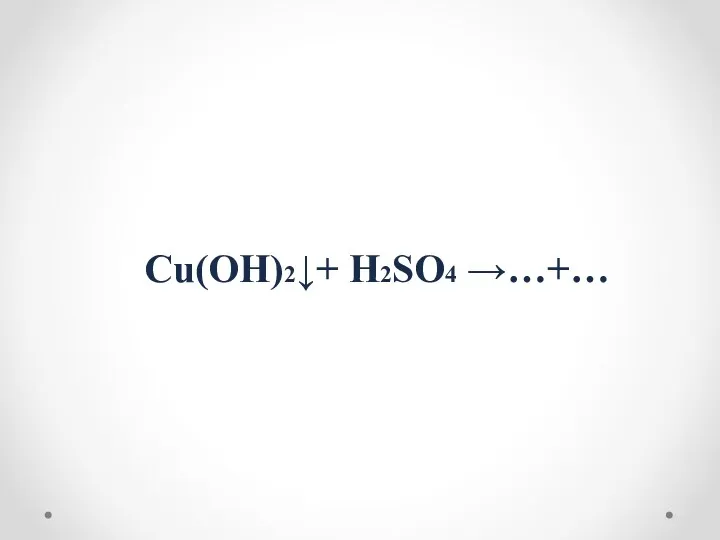















 Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Хімічний елемент францій. Історія відкриття
Хімічний елемент францій. Історія відкриття Янгишиева
Янгишиева Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Низкомолекулярные компоненты сыворотки крови
Низкомолекулярные компоненты сыворотки крови Обобщение по теме Основные классы неорганических веществ. 8 класс
Обобщение по теме Основные классы неорганических веществ. 8 класс Одноатомные спирты
Одноатомные спирты Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Alcohols. Learning Objectives
Alcohols. Learning Objectives Анализ лекарственных форм
Анализ лекарственных форм Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Белоктар. Биохимиясы
Белоктар. Биохимиясы Свойства концентрированной азотной кислоты
Свойства концентрированной азотной кислоты Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Хімічні формули речовин
Хімічні формули речовин Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Хімія у побуті
Хімія у побуті Термохімічні рівняння
Термохімічні рівняння Кaрбоновые кислоты
Кaрбоновые кислоты Основные понятия и законы химии
Основные понятия и законы химии Литология. Кремнистые породы
Литология. Кремнистые породы Элементы второй группы главной подгруппы
Элементы второй группы главной подгруппы Одноатомные спирты. Простые эфиры
Одноатомные спирты. Простые эфиры Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа Химические источники тока. Электролиз
Химические источники тока. Электролиз Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы