Слайд 2

Блиц-опрос.
1.Степень окисления атома азота в азотной кислоте -
2.Валентность атома азота в
азотной кислоте –
3.В молекуле азотной кислоты связь –
4. 3 – 10% - раствор аммиака называется –
5. Аммиак при нормальных условиях – это …
6. Ион аммония образуется по … механизму.
7. Оксид азота (II) является – … оксидом.
8. При окислении оксида азота (II) образуется …
9. Оксид азота (IV) – это …
10. Оксид азота (IV) является – … оксидом.
Слайд 3

Помощник №1
Шкала оценивания: каждый правильный ответ оценивается в – 0.5 балла.
1.Степень
окисления атома азота в азотной кислоте - + 5.
2.Валентность атома азота в азотной кислоте – IV.
3.В молекуле азотной кислоты связь – ковалентная полярная.
4. 3 – 10% - раствор аммиака называется – нашатырным спиртом.
5. Аммиак при нормальных условиях – это бесцветный газ с характерным запахом.
6. Ион аммония образуется по донорно - акцепторному механизму.
7. Оксид азота (II) является – несолеобразующим оксидом.
8. При окислении оксида азота (II) образуется оксид азота(IV).
9. Оксид азота (IV) – это бурый ядовитый газ с характерным удушливым запахом.
10. Оксид азота (IV) является – кислотным оксидом.
Слайд 4

Цель урока:
продолжить изучение азотной кислоты, рассмотреть химические свойства концентрированной азотной кислоты.
Слайд 5

Задачи урока:
Образовательные:
1) расширить представления учащихся об азотной кислоте;
2) продолжить формирование
умений записывать уравнения реакций, характеризующих свойства азотной кислоты.
Развивающие:
1) способствовать продолжению развития устойчивого интереса к химической науке;
2) применять полученные знания на практике и оценивать результаты выполненных действий;
3) совершенствовать умения обобщать и делать выводы.
Воспитательные:
1)воспитывать положительное отношение к знаниям, инициативность, способность преодолевать трудности для достижения цели;
2)формировать у каждого учащегося умения работать в группах, навыки взаимопроверки и взаимоконтроля.
Слайд 6

Свойства концентрированной азотной кислоты
1. Разложение при нагревании и под действием
света
4HNO3(конц.)= 4NO2 + O2 + 2H2O
Чем > t и чем > c (HNO3), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV).
Слайд 7

2. Окислительные свойства концентрированной азотной кислоты:
а) окисление неметаллов
При < c
(HNO3) – NO , при > c (HNO3) – NO2 .
S + 2HNO3 (40%) = H2SO4 + 2NO↑
S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O
3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑
P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O
Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO2.
C +4HNO3(конц.) = CO2 + 2H2O + 4NO2
Слайд 8

б) окисление сложных веществ
Иногда при окислении выделяется так много тепла,
что окисляющееся вещество загорается само собой, без предварительного подогревания.
Например: скипидар, бумага, солома, древесные опилки в концентрированной азотной кислоте самовоспламеняются.
3.Взаимодействие с белками.
При взаимодействии концентрированной азотной кислоты с белками образуются вещества ярко – желтого цвета.
При работе с концентрированной азотной кислотой необходимо соблюдать крайнюю осторожность: не допускать ее попадания на кожу и одежду! В случае попадания кислоты на кожу смыть большим количеством проточной воды и обработать 2 % раствором соды
Слайд 9

4. Взаимодействие с металлами
а) с щелочными и щелочно – земельными металлами
образуется
Me(NO3)n + N2O + H2O ,например:
4Ca + 10HNO3(конц.) = 4Ca(NO3)2 + N2O +5 H2O;
б) с Fe,Cr,Al,Au,Pt,Ta, Rh,Ir не взаимодействует;
в) с другими тяжелыми металлами образуется
Me(NO3)n + NO2 + H2O, например:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O.
Слайд 10

Физкультминутка
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками
крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Повороты вправо-влево
Плавно производим. (Повороты туловища влево и вправо)
Наклоняемся легко,
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)
Слайд 11

Обобщающее закрепление
Общая закономерность при взаимодействии азотной кислоты с металлами: чем
больше разбавлена кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение увеличение
концентрации активности
кислоты металла
Слайд 12
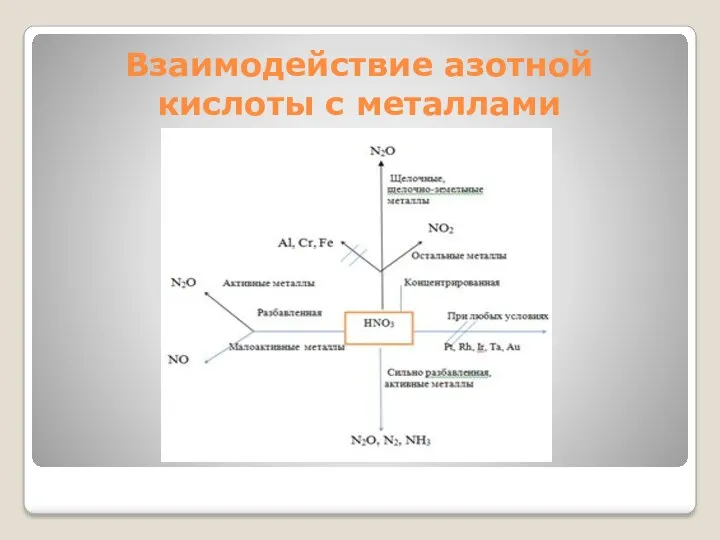
Взаимодействие азотной кислоты с металлами
Слайд 13

Помощник №2
а)3Ag 0+4HN+5O3(разб.) =3Ag+NO3 + N+2O + 2H2O
Ag0 -1e –Ag+ ,
3 , окисляется, восстановитель
N+5 +3e – N+2, 1 , восстанавливается, окислитель
б)Ag0 +2HN+5O3(конц.) =Ag+NO3 + N+4O2 +H2O
Ag0 -1e – Ag+ ,1 , окисляется, восстановитель
N+5 +1e – N+4 , 1 , восстанавливается, окислитель
Слайд 14

Домашнее задание
Изучите материал § 27 учебника, выполните тестовые задания в конце
параграфа. Используя электронное приложение, ознакомьтесь с видеофрагментами к параграфу













 Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Химическая связь
Химическая связь Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Растворы
Растворы Сложные вопросы ЕГЭ по химии
Сложные вопросы ЕГЭ по химии Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Периодические изменения свойств химических элементов
Периодические изменения свойств химических элементов Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Практична робота 3 Самедова Софія (1)
Практична робота 3 Самедова Софія (1) Определение критических точек двойного сплава
Определение критических точек двойного сплава Релаксационные процессы в полимерах
Релаксационные процессы в полимерах Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Каучук, резина и другие
Каучук, резина и другие Розділення неоднорідної суміші. Практична робота № 2
Розділення неоднорідної суміші. Практична робота № 2 Строение атома. Теории строения атома
Строение атома. Теории строения атома Агрегатные состояния вещества
Агрегатные состояния вещества Органическая химия. Подготовка к контрольной работе № 2
Органическая химия. Подготовка к контрольной работе № 2 Кремний и его соединения. 9 класс
Кремний и его соединения. 9 класс Деструктивные процессы переработки нефти
Деструктивные процессы переработки нефти