Содержание
- 2. КЛАССИФИКАЦИЯ: первая попытка… Антуан Лоран Лавуазье (1787 г.) Простые вещества (состоят из атомов одинаковых элементов) Оксиды
- 3. ГЛАВНОЕ В КЛАССИФИКАЦИИ: классификационный признак! Нет универсальной классификации, существует множество ее видов, например: По «природе происхождения»
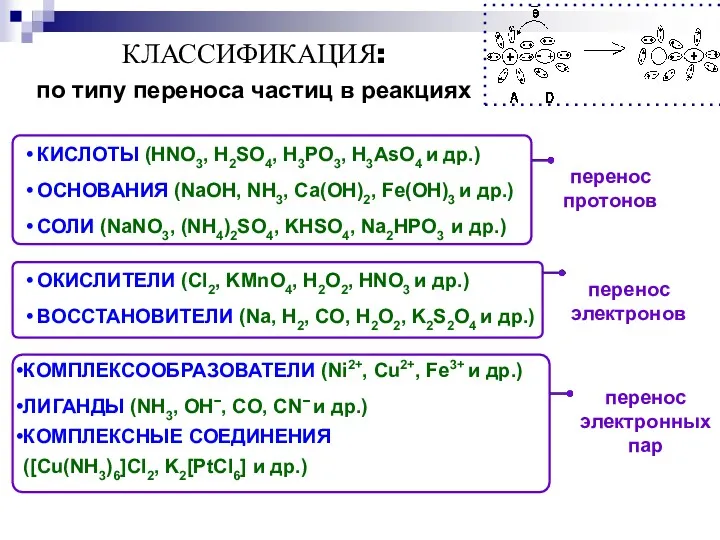
- 4. КЛАССИФИКАЦИЯ: по типу переноса частиц в реакциях КИСЛОТЫ (HNO3, H2SO4, H3PO3, H3AsO4 и др.) ОСНОВАНИЯ (NaOH,
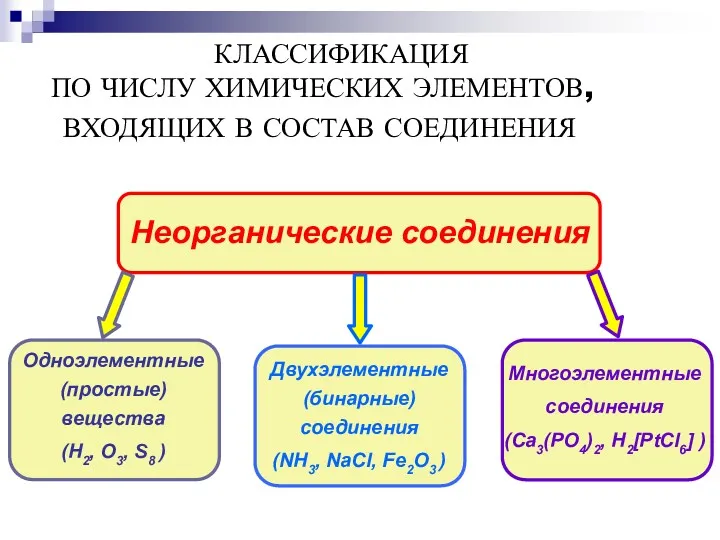
- 5. КЛАССИФИКАЦИЯ ПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ Неорганические соединения Одноэлементные (простые) вещества (H2, O3,
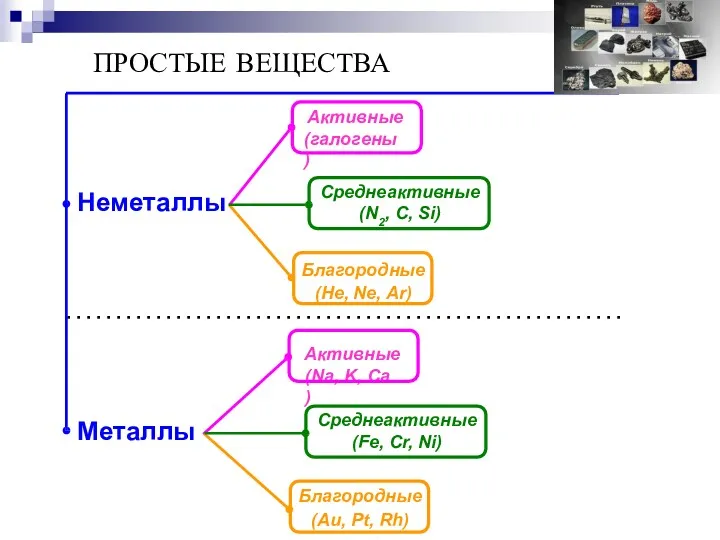
- 6. ПРОСТЫЕ ВЕЩЕСТВА Неметаллы Активные (галогены ) Среднеактивные (N2, С, Si) Металлы Благородные (He, Ne, Ar) Активные
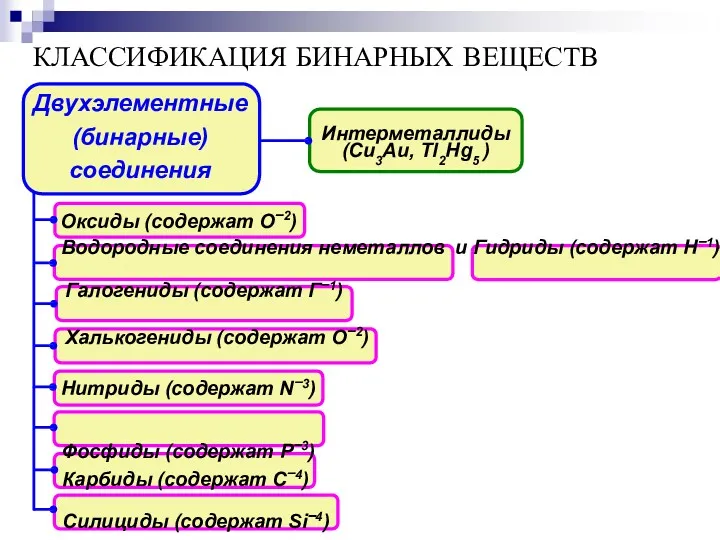
- 7. КЛАССИФИКАЦИЯ БИНАРНЫХ ВЕЩЕСТВ (бинарные) соединения Оксиды (содержат О−2) Водородные соединения неметаллов и Гидриды (содержат H−1) Галогениды
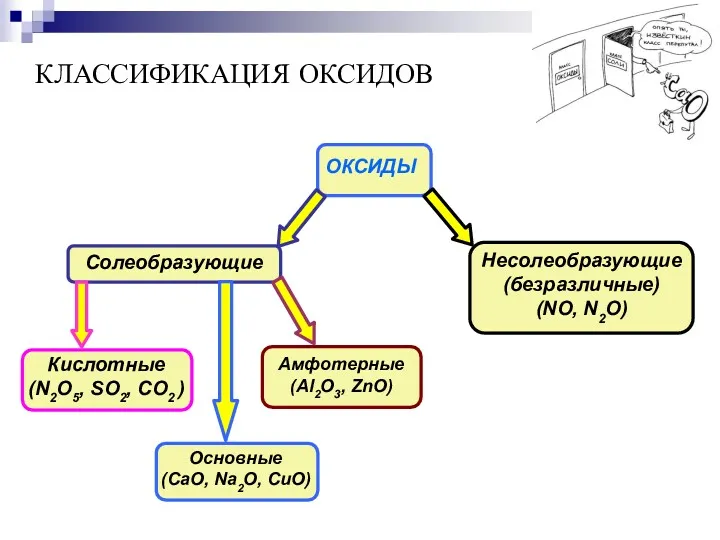
- 8. КЛАССИФИКАЦИЯ ОКСИДОВ ОКСИДЫ Солеобразующие Кислотные (N2O5, SO2, CO2 ) Несолеобразующие (безразличные) (NO, N2O) Основные (CaO, Na2O,
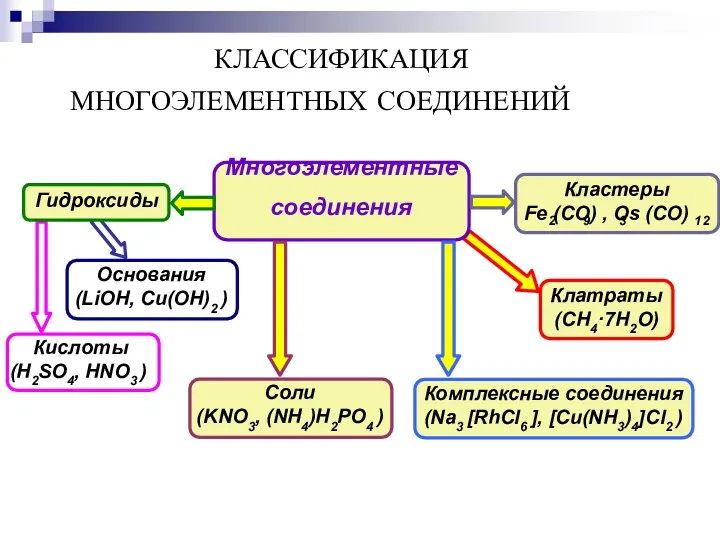
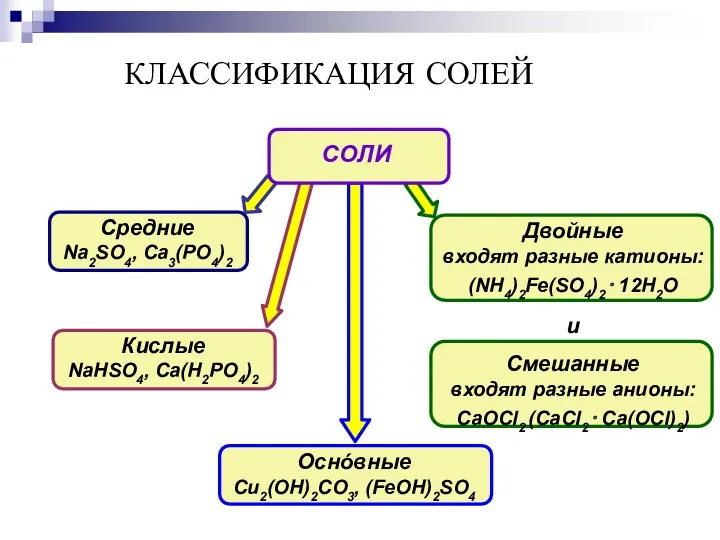
- 9. Гидроксиды КЛАССИФИКАЦИЯ МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЙ Кислоты (H2SO4, HNO3 ) Основания (LiOH, Cu(OH)2 ) Многоэлементные соединения Комплексные соединения
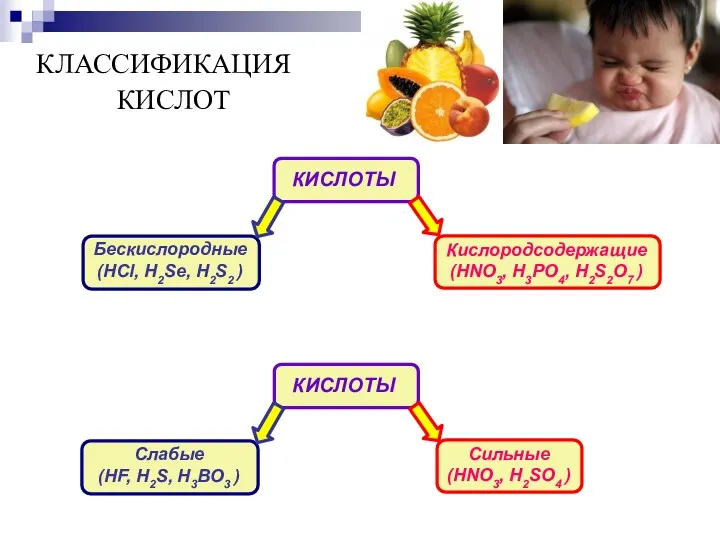
- 10. КЛАССИФИКАЦИЯ КИСЛОТ КИСЛОТЫ Бескислородные (HCl, H2Se, H2S2 ) Кислородсодержащие (HNO3, H3PO4, H2S2O7 ) Слабые (HF, H2S,
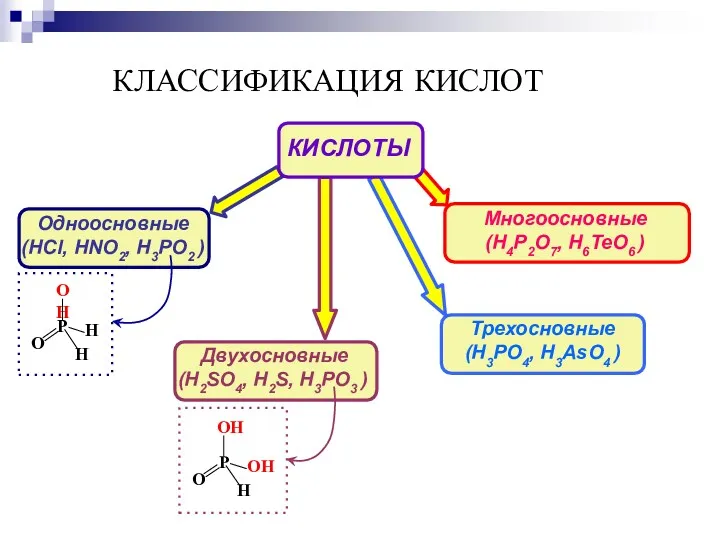
- 11. КЛАССИФИКАЦИЯ КИСЛОТ Одноосновные (HCl, HNO2, H3PO2 ) Многоосновные (H4P2O7, H6TeO6 ) Двухосновные (H2SO4, H2S, H3PO3 )
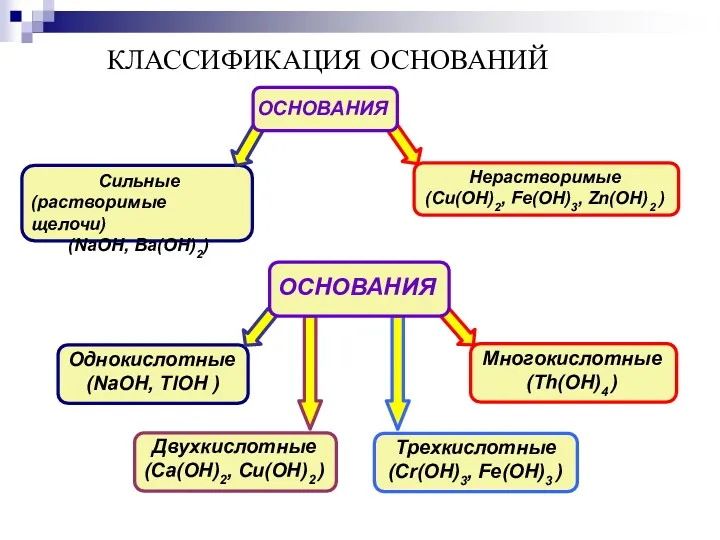
- 12. Сильные (растворимые щелочи) (NaOH, Ba(OH)2) КЛАССИФИКАЦИЯ ОСНОВАНИЙ Нерастворимые (Cu(OH)2, Fe(OH)3, Zn(OH)2 ) Однокислотные (NaOH, TlOH )
- 13. Двойные входят разные катионы: (NH4)2Fe(SO4)2 ⋅ 12H2O и Смешанные входят разные анионы: CaOCl2 (CaCl2 ⋅ Ca(OCl)2)
- 14. НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 15. ПРАВИЛА ДЛЯ СОСТАВЛЕНИЯ НАЗВАНИЙ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (правила комиссии ИЮПАК) ТРАДИЦИОННАЯ НОМЕНКЛАТУРА «РУССКАЯ» НОМЕНКЛАТУРА НЕНОМЕНКЛАТУРНЫЕ
- 16. НАЗВАНИЯ И ОБОЗНАЧЕНИЯ ЭЛЕМЕНТОВ И ИЗОТОПОВ Элементы: символы и названия элементов приведены в ПС. Изотопы: обозначение
- 17. ЗАПИСЬ СИМВОЛОВ ИОНОВ заряд иона – надстрочный индекс справа знак (+ или −) после цифры: SO42−
- 18. НАЗВАНИЯ КАТИОНОВ (правила ИЮПАК) одноэлементные одно атомные катионы: Cu+ – катион меди(I) Cu2+ – катион меди(II)
- 19. многоэлементные катионы: UO2+ – катион диоксоурана(V) [Ti(H2O)6]3+ – катион гексаакватитана(III) специальные названия катионов: в состав катиона
- 20. одноэлементные одно атомные анионы: -ид + -ион Cl− – хлорид-ион S2− – сульфид-ион H− – гидрид-ион
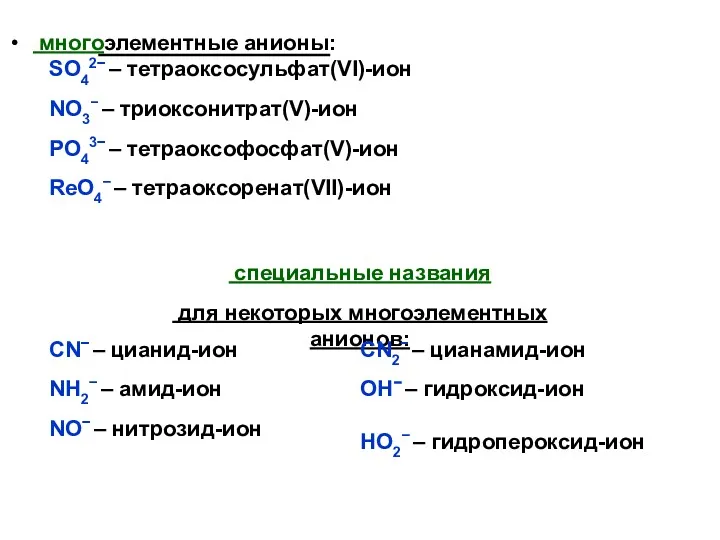
- 21. многоэлементные анионы: SO42− – тетраоксосульфат(VI)-ион NO3− – триоксонитрат(V)-ион РO43− – тетраоксофосфат(V)-ион ReO4− – тетраоксоренат(VII)-ион специальные названия
- 22. НАЗВАНИЯ ПРОСТЫХ ВЕЩЕСТВ названия, как правило, происходят от названий соответствующих элементов для твердых аллотропных модификаций: α-,
- 23. БИНАРНЫЕ СОЕДИНЕНИЯ Запись формул: соединения металла и неметалла: сначала символ металла (слева в формуле), затем неметалла
- 24. СОЕДИНЕНИЯ НЕСКОЛЬКИХ МЕТАЛЛОВ (интерметаллиды) Названия: читают формулу справа налево, слова разделены дефисом, используют числовые приставки: Mg2Sn
- 25. СОЕДИНЕНИЯ ДВУХ НЕМЕТАЛЛОВ ИЛИ МЕТАЛЛ-НЕМЕТАЛЛ Названия (ИЮПАК и традиционная номенклатура): читают формулу справа налево, название в
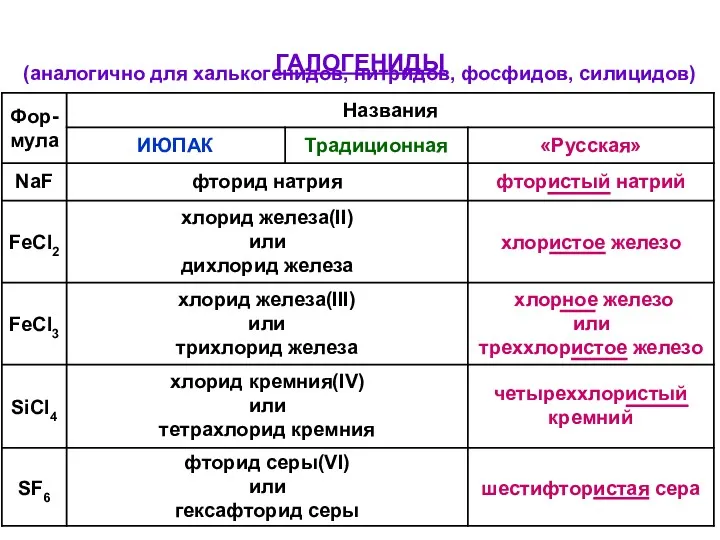
- 26. ГАЛОГЕНИДЫ (аналогично для халькогенидов, нитридов, фосфидов, силицидов)
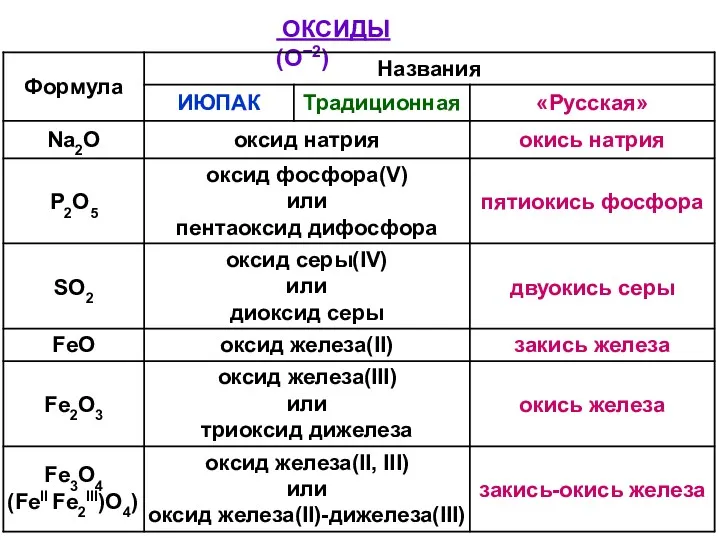
- 27. ОКСИДЫ (O−2)
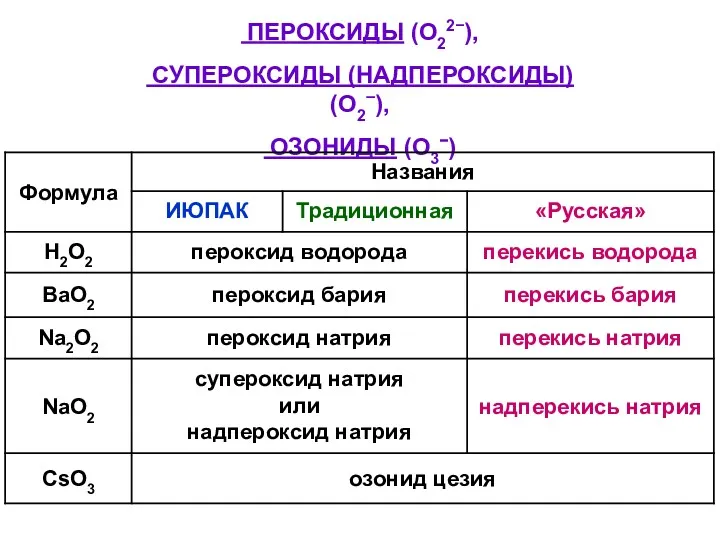
- 28. ПЕРОКСИДЫ (O22−), СУПЕРОКСИДЫ (НАДПЕРОКСИДЫ) (O2−), ОЗОНИДЫ (O3−)
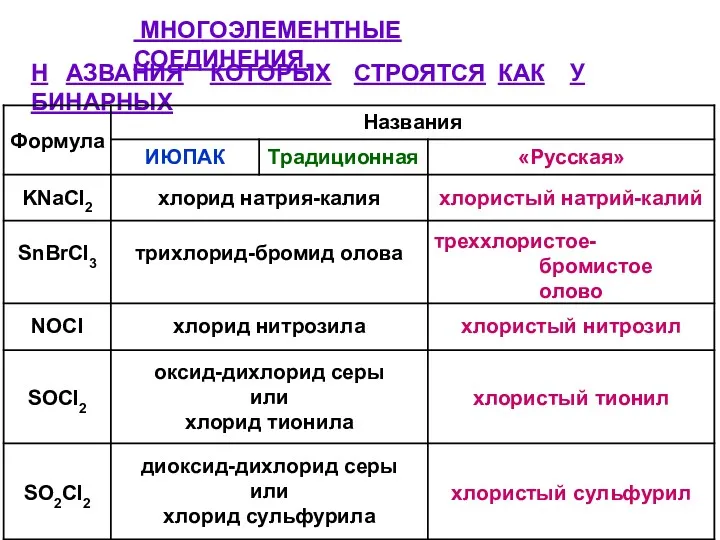
- 29. МНОГОЭЛЕМЕНТНЫЕ СОЕДИНЕНИЯ, Н АЗВАНИЯ КОТОРЫХ СТРОЯТСЯ КАК У БИНАРНЫХ
- 30. ВОДОРОДНЫЕ СОЕДИНЕНИЯ Соединения металла и водорода – гидриды LiH – гидрид лития CaH2 – гидрид кальция
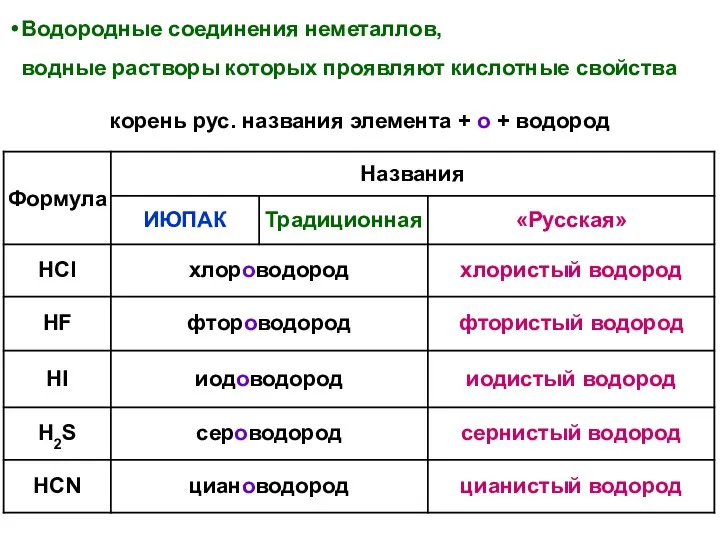
- 31. Водородные соединения неметаллов, водные растворы которых проявляют кислотные свойства корень рус. названия элемента + о +
- 32. Водородные соединения с одним атомом элементов 15 группы (кроме N) корень лат. названия элемента + ин
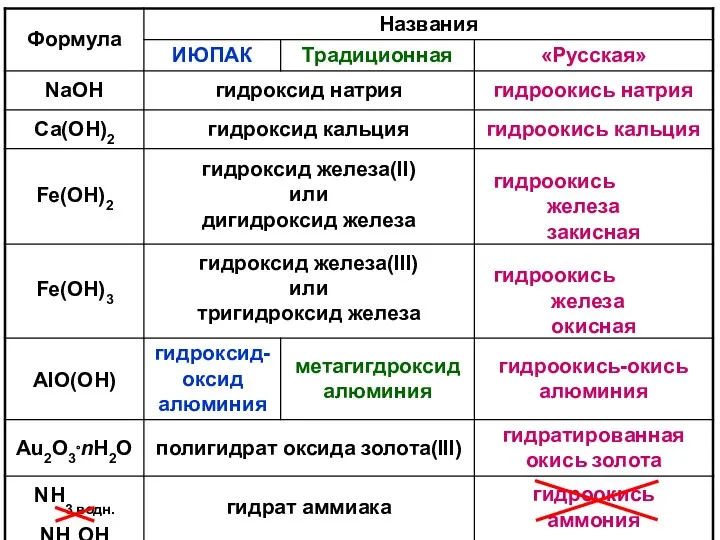
- 33. ОСНОВАНИЯ (гидроксиды металлов) Названия (ИЮПАК и традиционная номенклатура): название в два слова: первое слово: гидроксид второе
- 35. КИСЛОТЫ БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (водные растворы газообразных водородных соединений) Названия: в два слова первое слово: название водородного
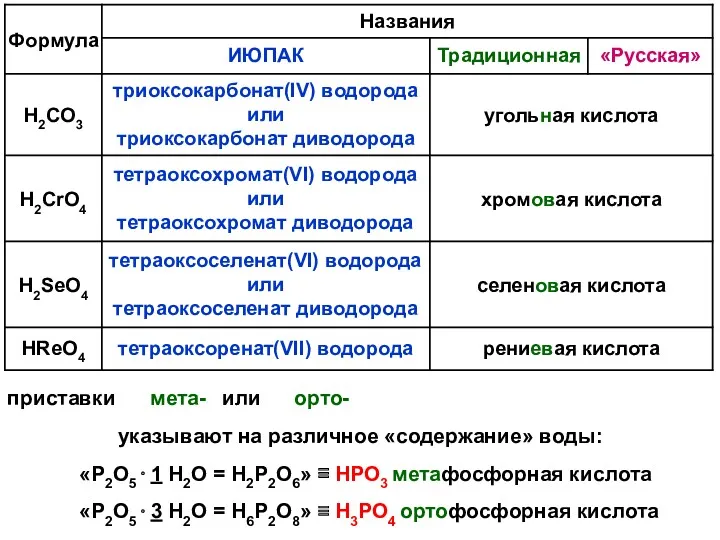
- 36. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ Названия (традиционная номенклатура): в два слова первое слово: корень рус. названия элемента + суффикс
- 37. приставки мета- или орто- указывают на различное «содержание» воды: «P2O5 ⋅ 1 H2O = H2P2O6» ≡
- 38. ЕСЛИ ВОЗМОЖНЫ ДВЕ РАЗНЫЕ СТ. ОКИСЛ. для высшей степени окисления – суффиксы -н-, -ов- или -ев-
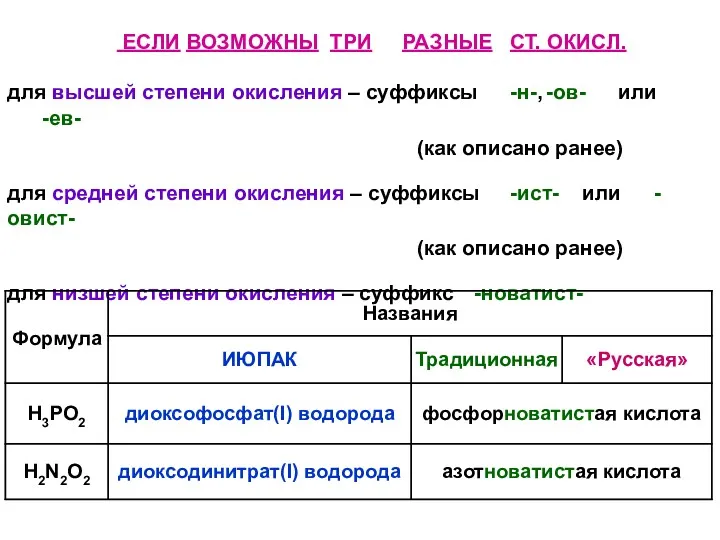
- 39. ЕСЛИ ВОЗМОЖНЫ ТРИ РАЗНЫЕ СТ. ОКИСЛ. для высшей степени окисления – суффиксы -н-, -ов- или -ев-
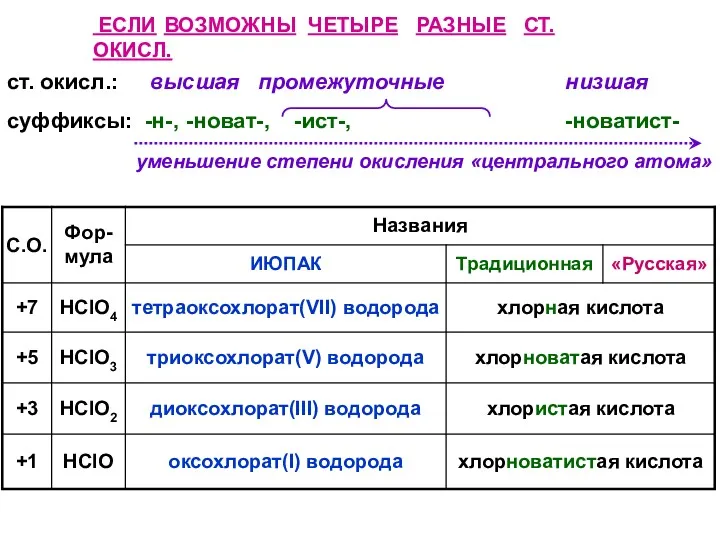
- 40. ЕСЛИ ВОЗМОЖНЫ ЧЕТЫРЕ РАЗНЫЕ СТ. ОКИСЛ. ст. окисл.: высшая промежуточные суффиксы: -н-, -новат-, -ист-, низшая -новатист-
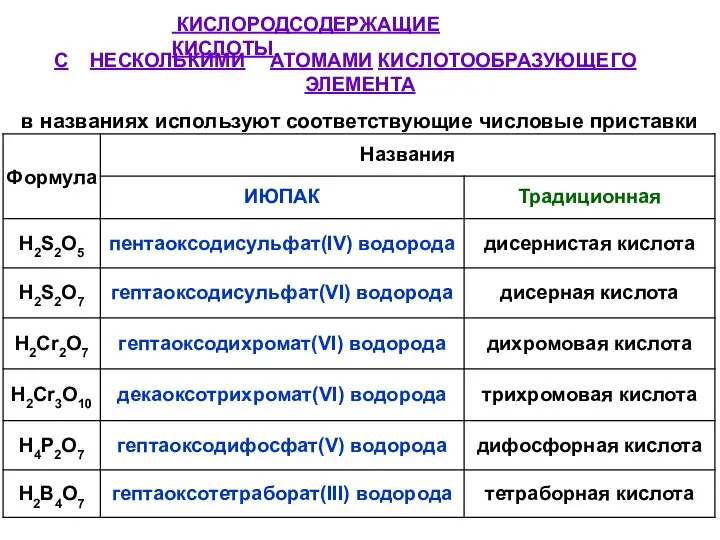
- 41. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ С НЕСКОЛЬКИМИ АТОМАМИ КИСЛОТООБРАЗУЮЩЕГО ЭЛЕМЕНТА в названиях используют соответствующие числовые приставки
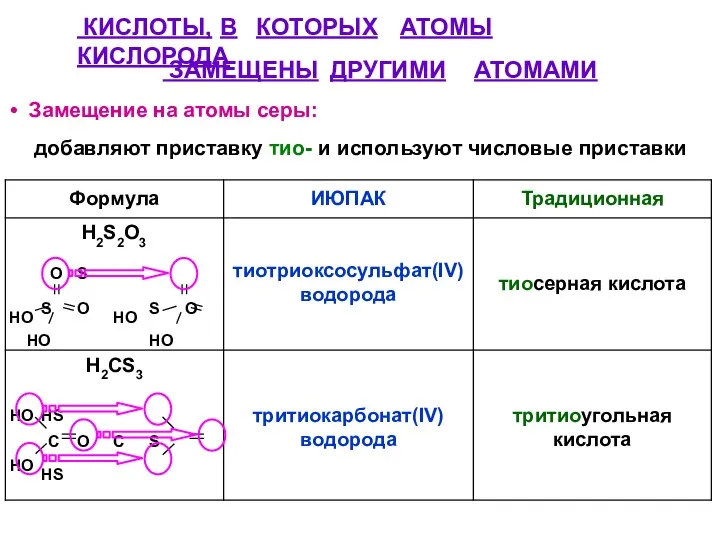
- 42. КИСЛОТЫ, В КОТОРЫХ АТОМЫ КИСЛОРОДА ЗАМЕЩЕНЫ ДРУГИМИ АТОМАМИ Замещение на атомы серы: добавляют приставку тио- и
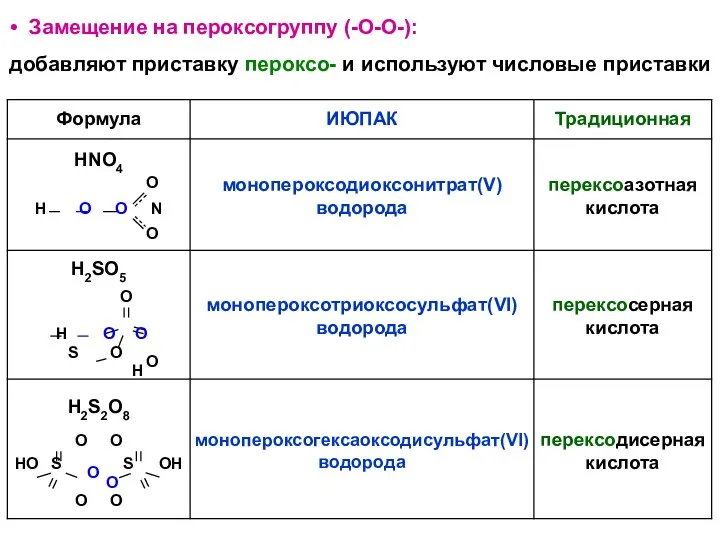
- 43. Замещение на пероксогруппу (-О-О-): добавляют приставку пероксо- и используют числовые приставки
- 44. СОЛИ КИСЛОРОДСОДЕРЖАЩИХ КИСЛОТ СРЕДНИЕ СОЛИ Названия (традиционная номенклатура): в два слова первое слово: второе слово: название
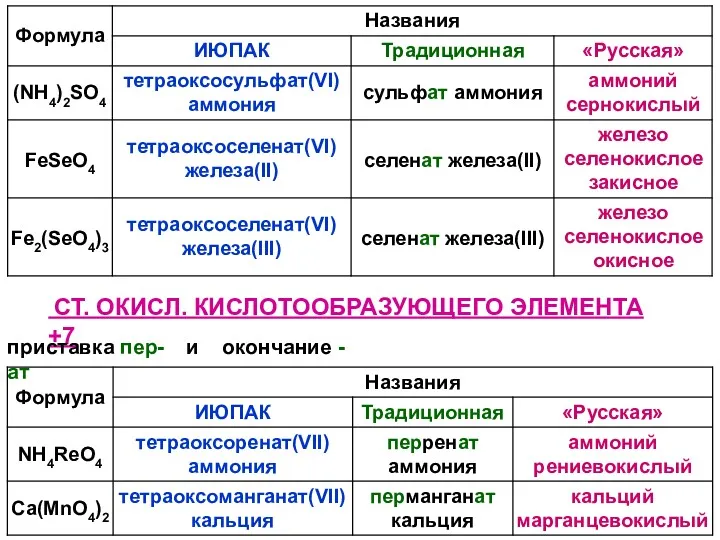
- 45. СТ. ОКИСЛ. КИСЛОТООБРАЗУЮЩЕГО ЭЛЕМЕНТА +7 приставка пер- и окончание -ат
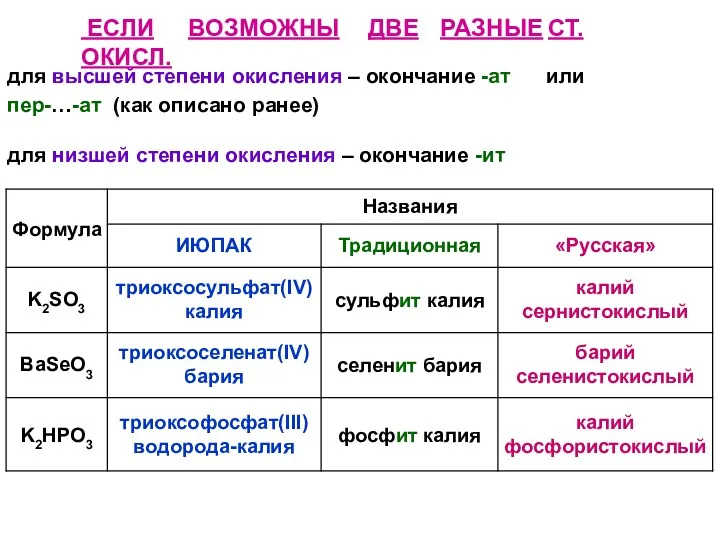
- 46. ЕСЛИ ВОЗМОЖНЫ ДВЕ РАЗНЫЕ СТ. ОКИСЛ. для высшей степени окисления – окончание -ат или пер-…-ат (как
- 47. ЕСЛИ ВОЗМОЖНЫ ТРИ РАЗНЫЕ СТ. ОКИСЛ. для высшей степени окисления – окончание -ат или пер-…-ат (как
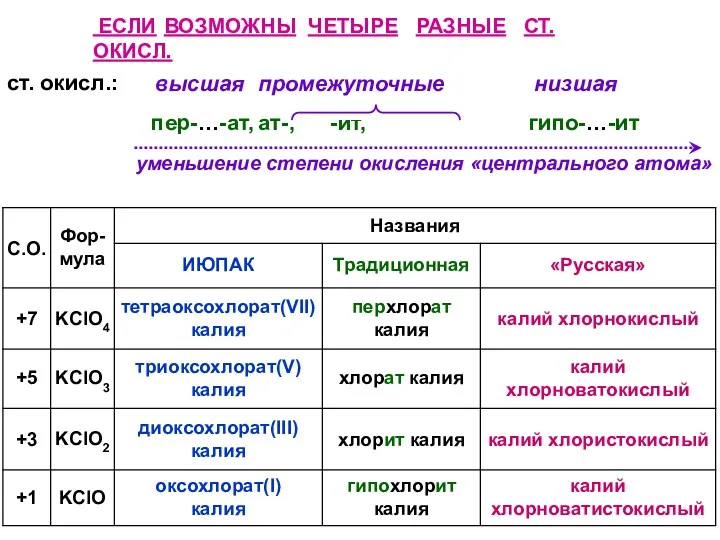
- 48. ЕСЛИ ВОЗМОЖНЫ ЧЕТЫРЕ РАЗНЫЕ СТ. ОКИСЛ. ст. окисл.: высшая промежуточные пер-…-ат, ат-, -ит, низшая гипо-…-ит уменьшение
- 49. СРЕДНИЕ СОЛИ КИСЛОРОДСОДЕРЖАЩИХ КИСЛОТ С НЕСКОЛЬКИМИ АТОМАМИ КИСЛОТООБРАЗУЮЩЕГО ЭЛЕМЕНТА в названиях используют: соответствующие окончания и/или приставки
- 50. СРЕДНИЕ СОЛИ КИСЛОТ, В КОТОРЫХ АТОМЫ O ЗАМЕЩЕНЫ АТОМАМИ S ИЛИ ПЕРОКСОГРУППАМИ добавляют приставки тио- или
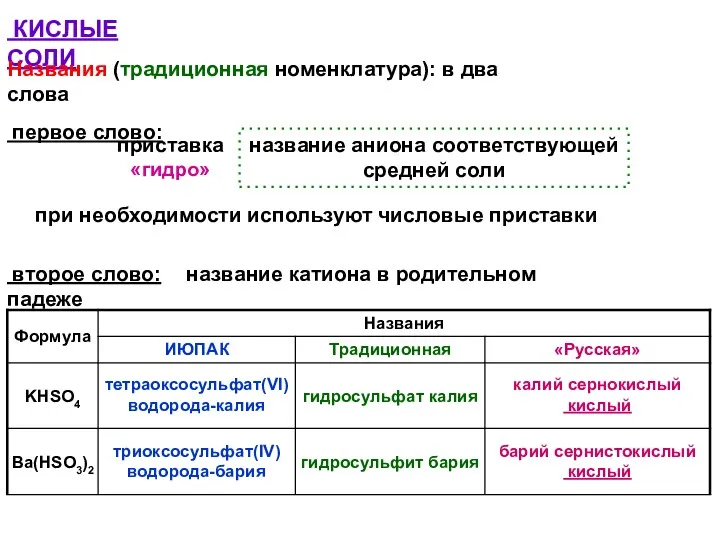
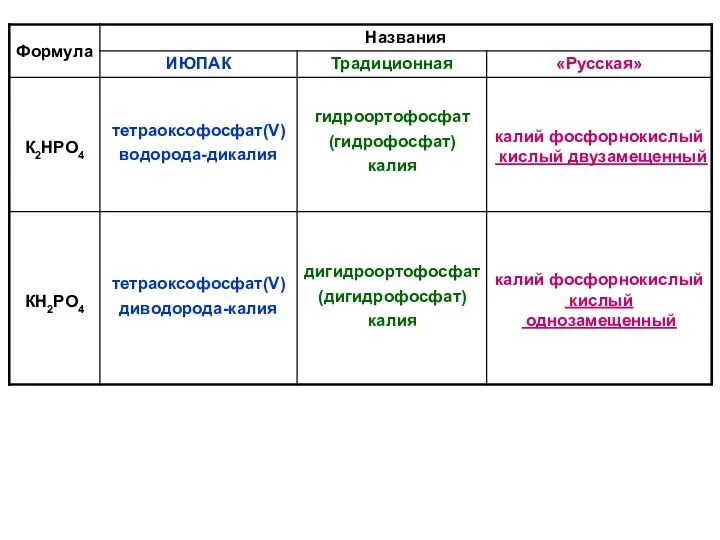
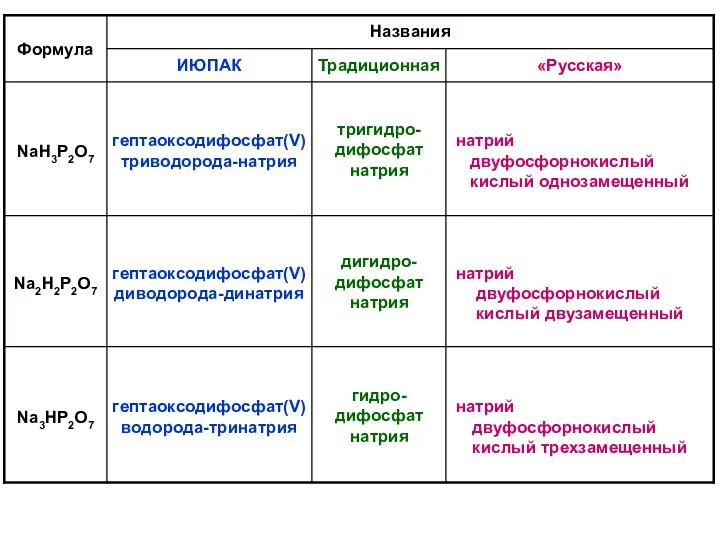
- 51. КИСЛЫЕ СОЛИ Названия (традиционная номенклатура): в два слова первое слово: при необходимости используют числовые приставки второе
- 54. НАЗВАНИЯ ОСНόВНЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют
- 55. НАЗВАНИЯ КРИСТАЛЛОГИДРАТОВ названия (по правилам ИЮПАК и ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ) состоят из: гидрат (при необходимости используют числовые
- 57. Скачать презентацию







![многоэлементные катионы: UO2+ – катион диоксоурана(V) [Ti(H2O)6]3+ – катион гексаакватитана(III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/194760/slide-18.jpg)

















 Получение и свойства азота
Получение и свойства азота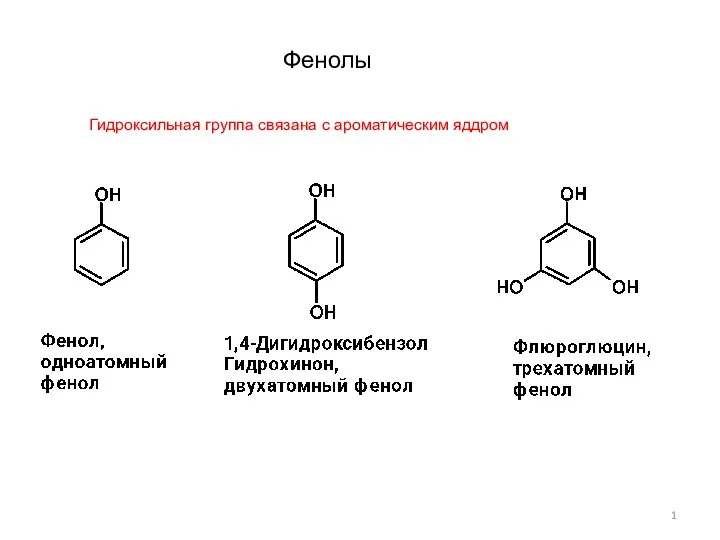 Фенолы-1
Фенолы-1 Свойства моторных топлив
Свойства моторных топлив Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Нахождение металлов в природе. Общие способы получения металлов. 9 класс
Нахождение металлов в природе. Общие способы получения металлов. 9 класс Органическая химия. Пособие
Органическая химия. Пособие Степень окисления
Степень окисления Химические реакции. Классификация. Повторение
Химические реакции. Классификация. Повторение Основные электрохимические процессы
Основные электрохимические процессы Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Кислород
Кислород Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Изомерия. Типы изомерии
Изомерия. Типы изомерии Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Природный газ
Природный газ Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Растворы и растворители
Растворы и растворители Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер
Биологиялық қауіп: экопатогендер, қауіпті биологиялық агенттер, биорегуляторлар. Табиғи токсиндер Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Арены. Бензол
Арены. Бензол Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Благородные металлы
Благородные металлы Степень окисления
Степень окисления