Содержание
- 2. Аминокислоты Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
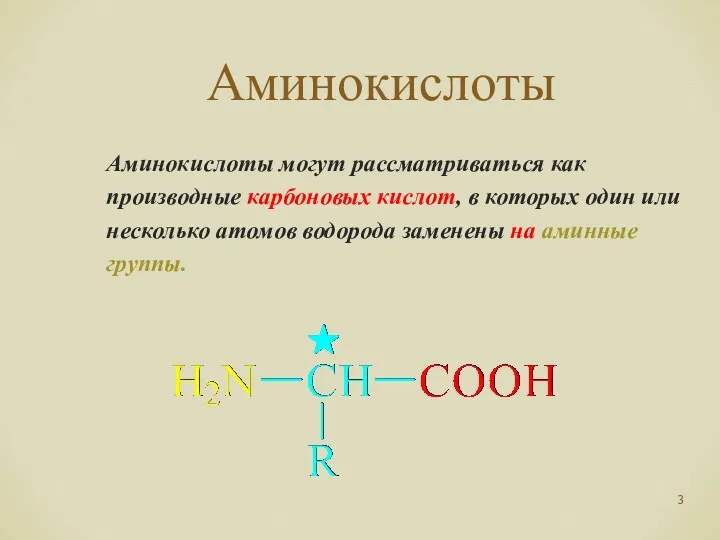
- 3. Аминокислоты Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены
- 4. Протеиногенные аминокислоты В процессе биосинтеза белка в полипептидную цепь включаются 20 протеиногенных, или стандартных α-аминокислот, кодируемых
- 5. Классификация По радикалу Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан, Полярные незаряженные (заряды
- 6. Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей, в количествах,
- 7. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
- 8. Белки Белки – это сложные органические вещества, выполняющие в клетке важные функции. Они представляют собой гигантские
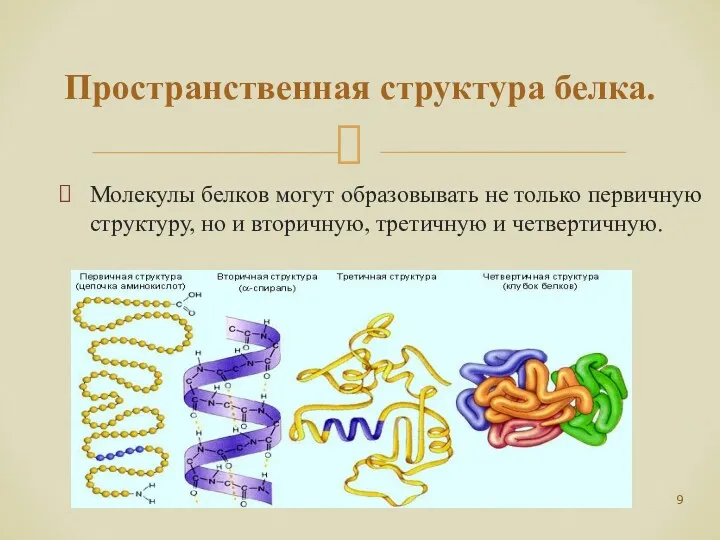
- 9. Пространственная структура белка. Молекулы белков могут образовывать не только первичную структуру, но и вторичную, третичную и
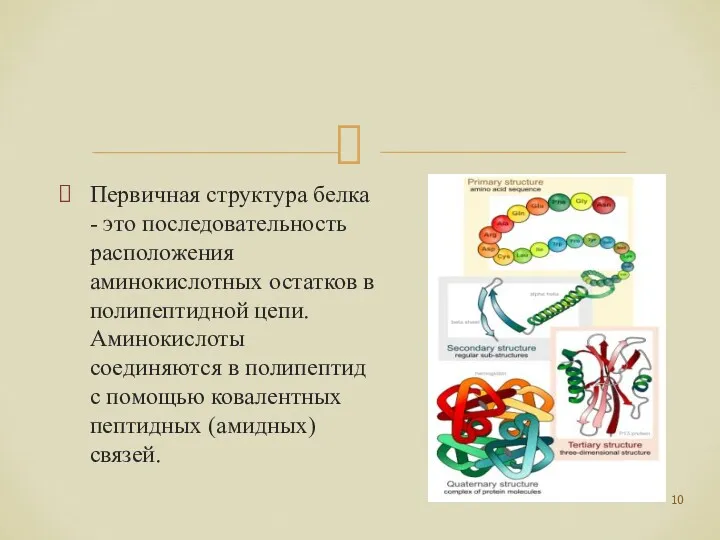
- 10. Первичная структура белка - это последовательность расположения аминокислотных остатков в полипептидной цепи. Аминокислоты соединяются в полипептид
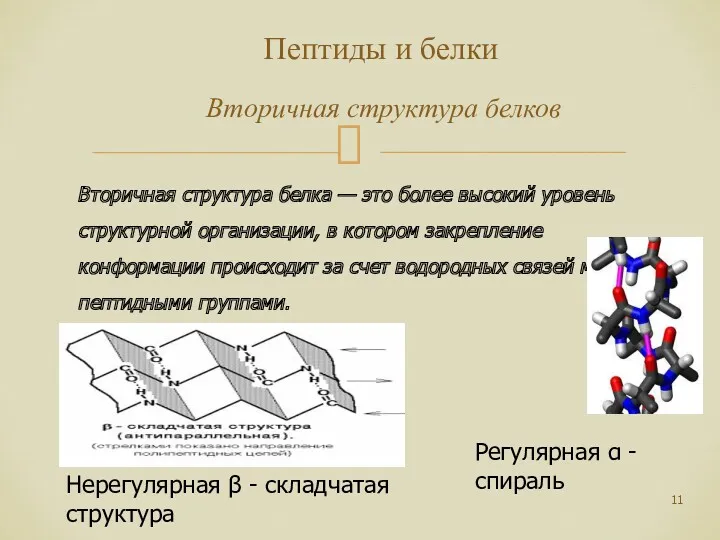
- 11. Пептиды и белки Вторичная структура белков Вторичная структура белка — это более высокий уровень структурной организации,
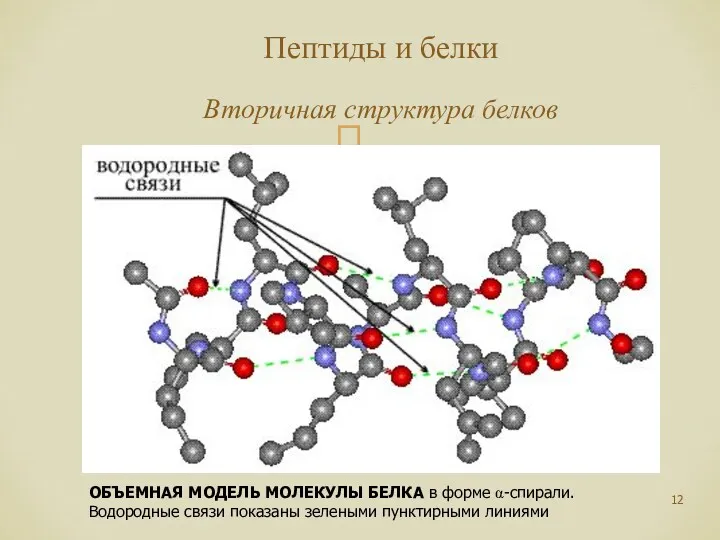
- 12. Пептиды и белки Вторичная структура белков ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме α-спирали. Водородные связи показаны
- 13. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
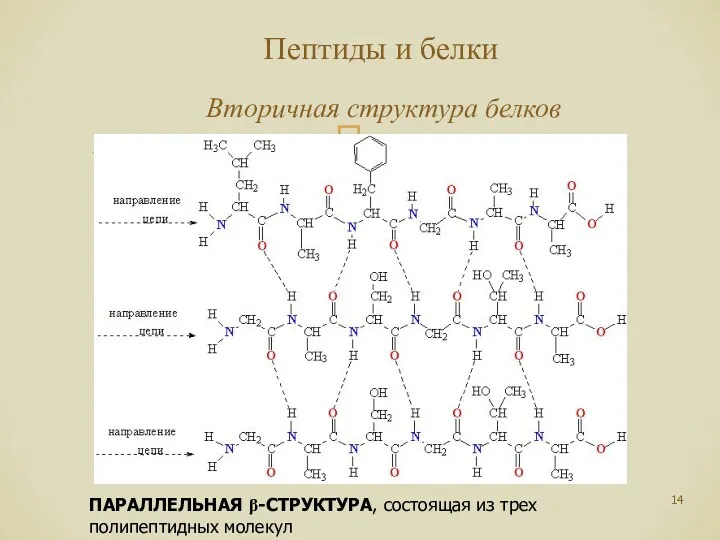
- 14. Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
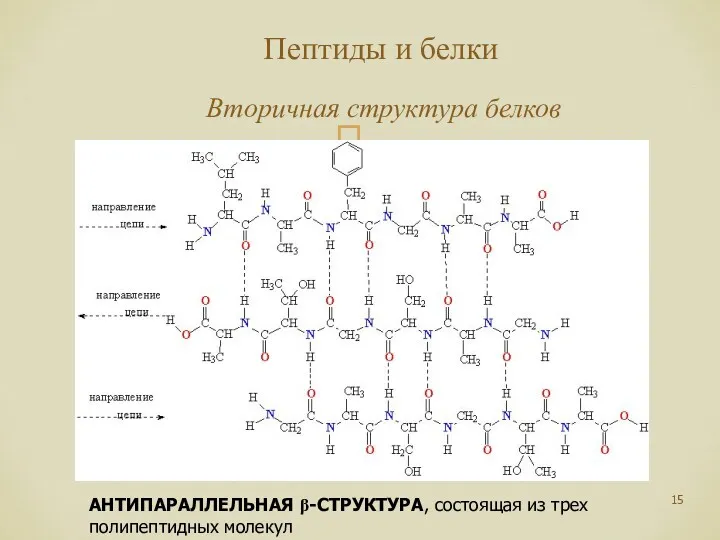
- 15. Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
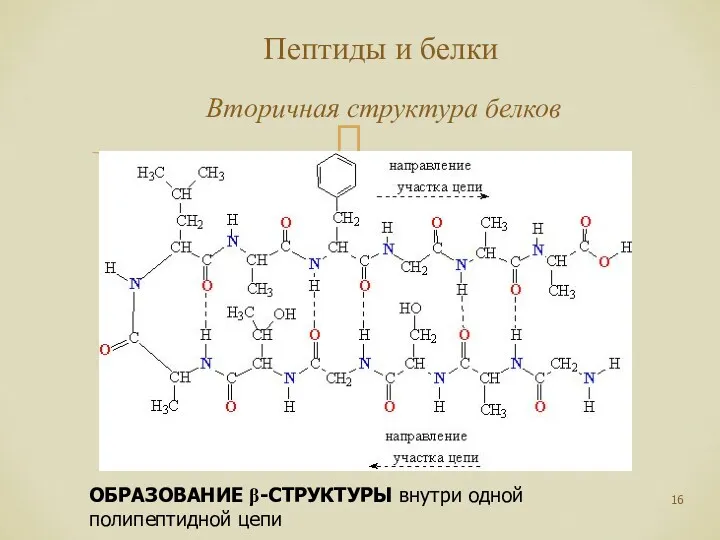
- 16. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри одной полипептидной цепи
- 17. Пептиды и белки Вторичная структура белков β-структура белка
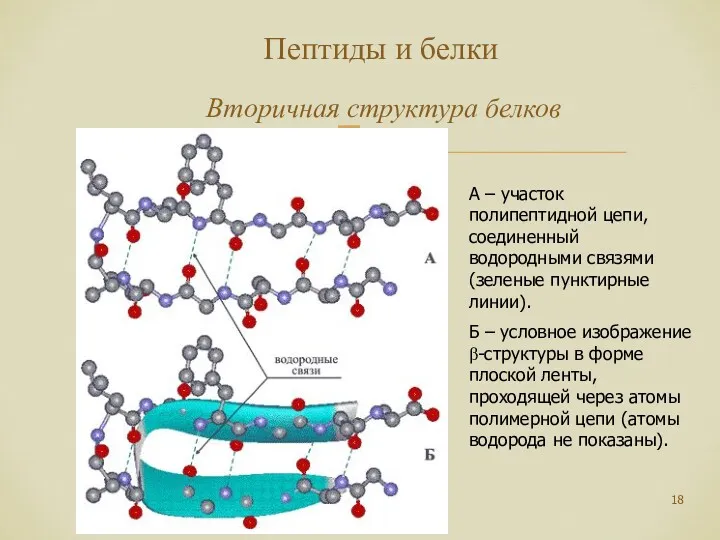
- 18. Пептиды и белки Вторичная структура белков А – участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные
- 19. Третичная структура белка - это пространственная конформация полипептида, имеющего вторичную структуру, и обусловленная взаимодействиями между радикалами.
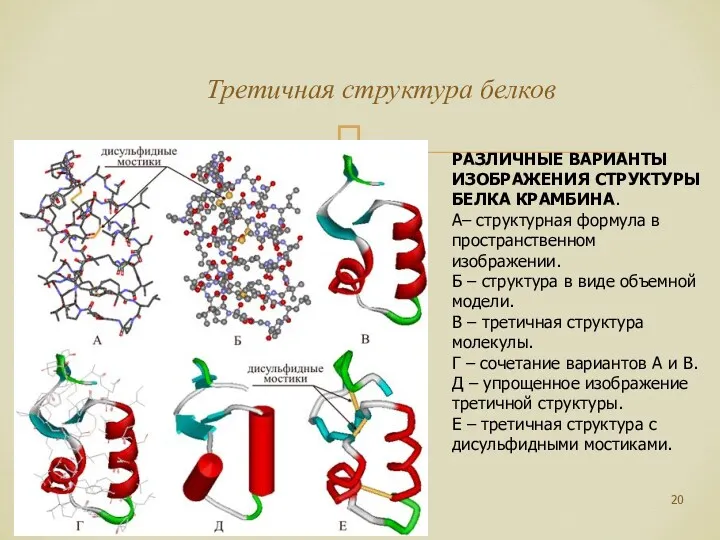
- 20. Третичная структура белков РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в пространственном изображении. Б
- 21. Четвертичная структура белка - это агрегация двух или большего числа полипептидных цепей, имеющих третичную структуру, в
- 22. Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков присутствуют свободные сульфгидридные
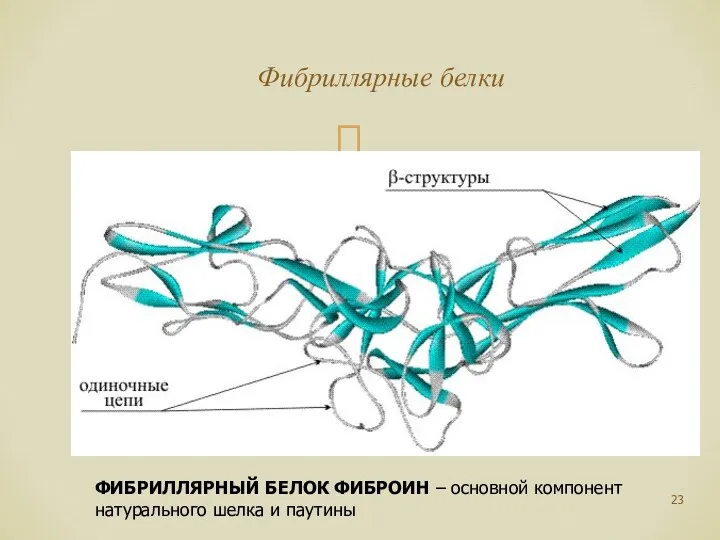
- 23. Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка и паутины
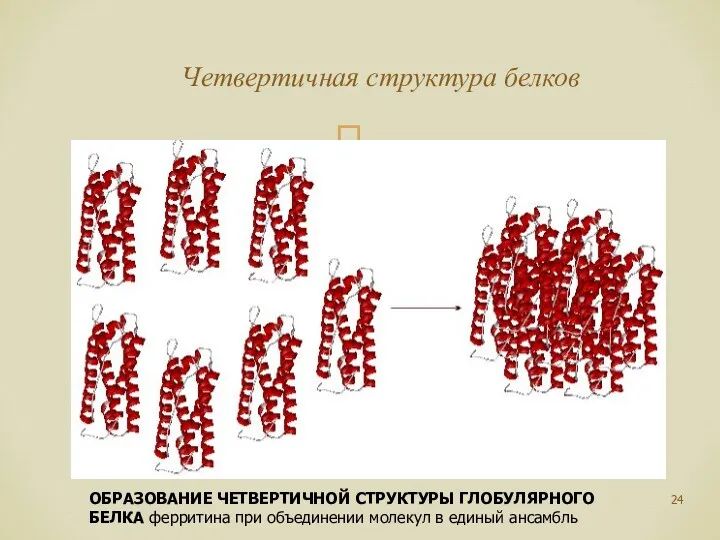
- 24. Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в единый ансамбль
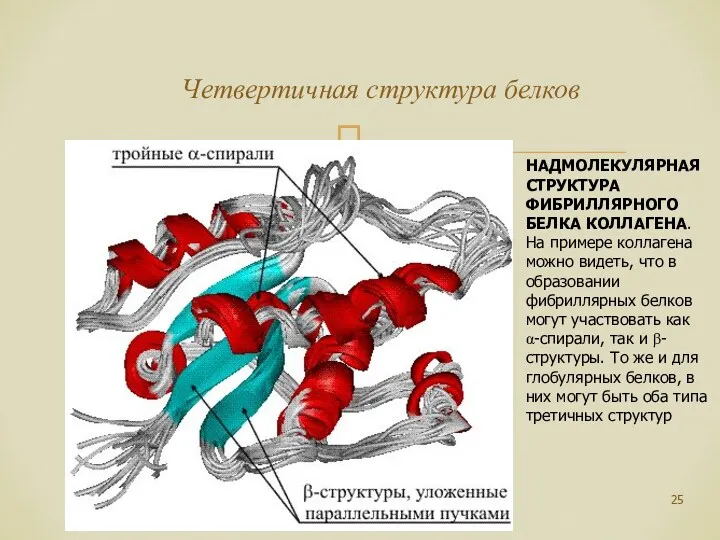
- 25. Четвертичная структура белков НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть, что в образовании
- 26. Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры
- 28. Скачать презентацию












 Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Коррозия металлов и способы ее устранения
Коррозия металлов и способы ее устранения Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Материаловедение, как отрасль науки
Материаловедение, как отрасль науки Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас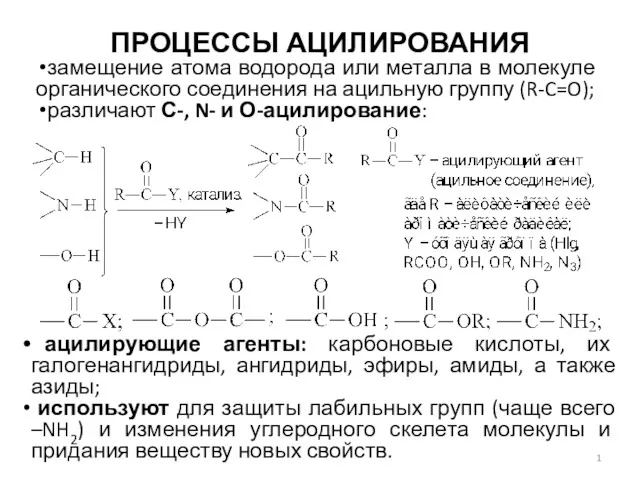 Процессы ацилирования
Процессы ацилирования Алкадиены
Алкадиены Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Энергетика химических процессов. (Лекция 2)
Энергетика химических процессов. (Лекция 2) Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Основные понятия и законы химии
Основные понятия и законы химии Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Химия вокруг нас
Химия вокруг нас Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Теория электролитической диссоциации
Теория электролитической диссоциации Классификация химических реакций
Классификация химических реакций Связь структуры и функций химических соединений. Задачи QSAR
Связь структуры и функций химических соединений. Задачи QSAR Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Полимеры (10 класс)
Полимеры (10 класс) Табиғаттағы биологиялық азотофиксация мәні мен масштабы
Табиғаттағы биологиялық азотофиксация мәні мен масштабы Реакционная способность соединений со связью углерод-гетероатом
Реакционная способность соединений со связью углерод-гетероатом Металлы. Общие свойства и получение
Металлы. Общие свойства и получение Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Химический элемент медь
Химический элемент медь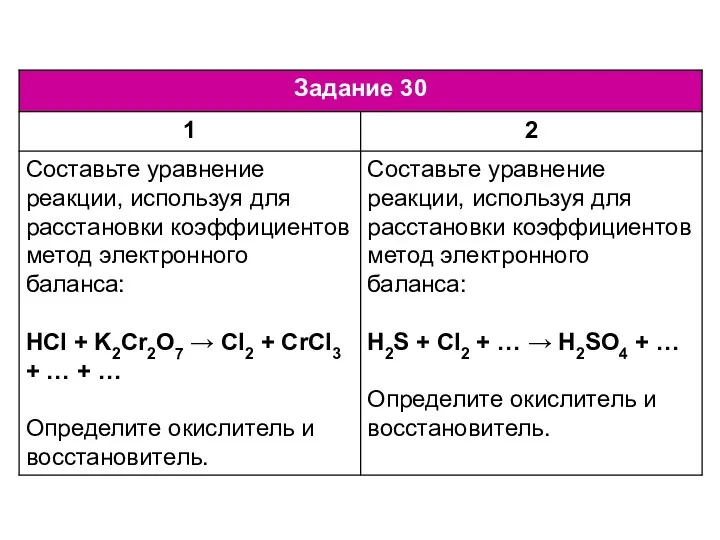 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс