Содержание
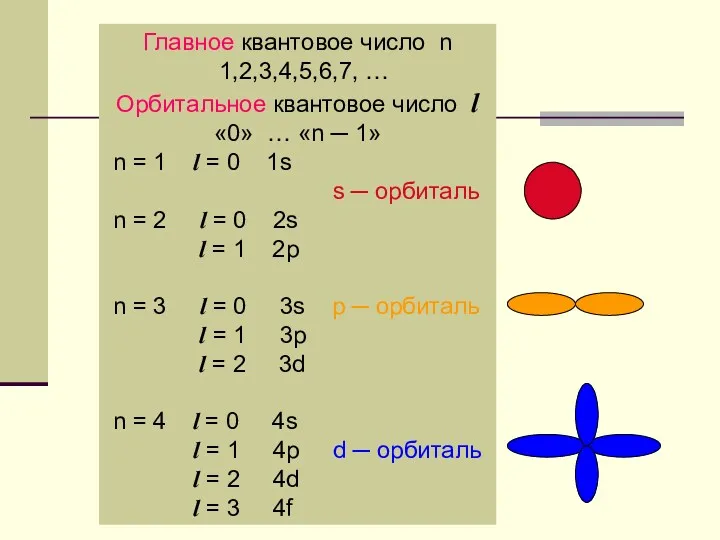
- 2. Главное квантовое число n 1,2,3,4,5,6,7, … Орбитальное квантовое число l «0» … «n ─ 1» n
- 3. Магнитное квантовое число –l,…, 0,…,+ l; N(ml) = (2 l + 1) = N(AO) l =
- 4. Принцип Паули. В атоме не может быть двух электронов, имеющих одинаковый набор квантовых чисел АО 1s:
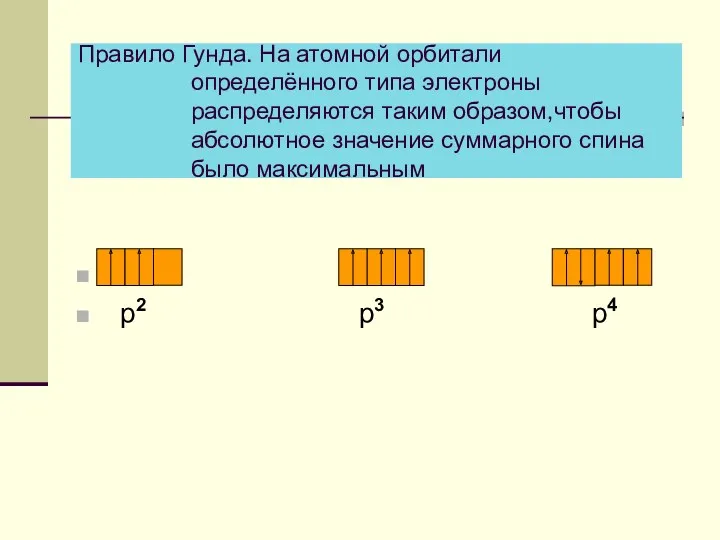
- 5. Правило Гунда. На атомной орбитали определённого типа электроны распределяются таким образом,чтобы абсолютное значение суммарного спина было
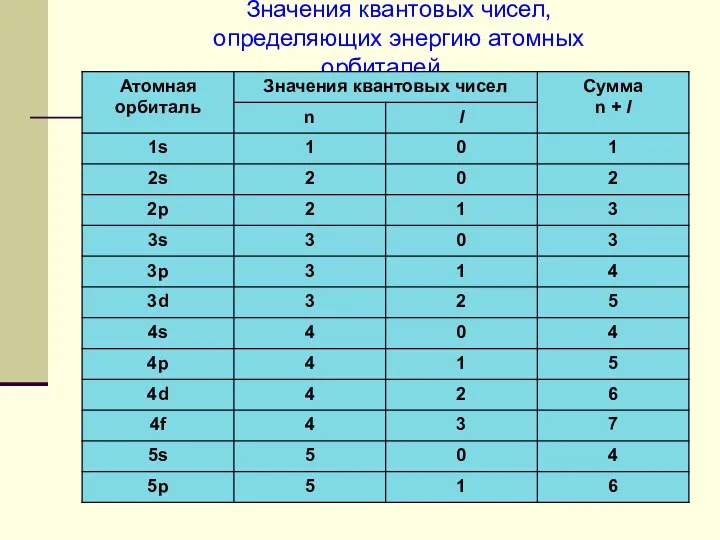
- 6. Значения квантовых чисел, определяющих энергию атомных орбиталей
- 8. Электронные формулы и распределение валентных электронов
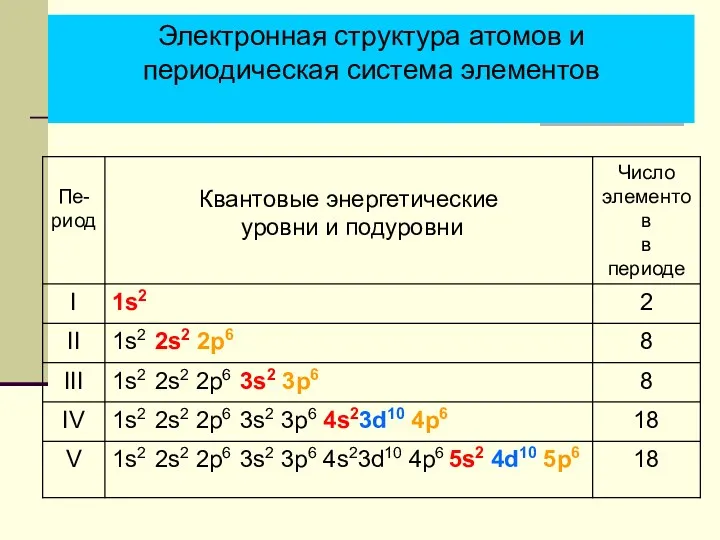
- 9. Электронная структура атомов и периодическая система элементов
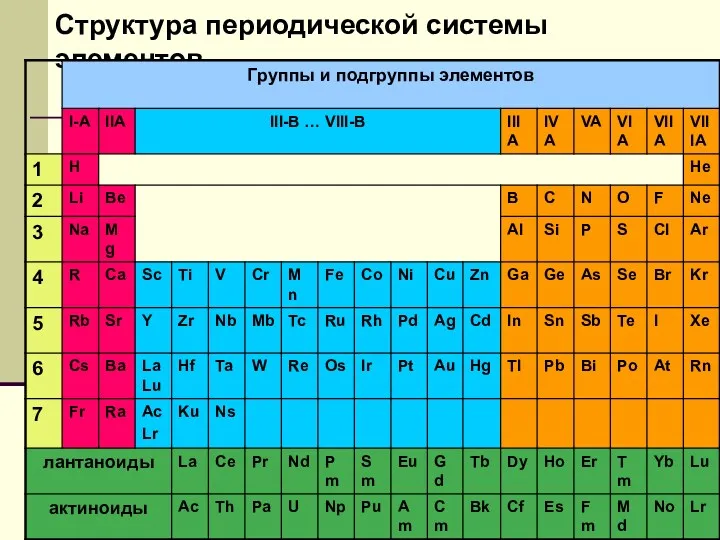
- 10. Структура периодической системы элементов
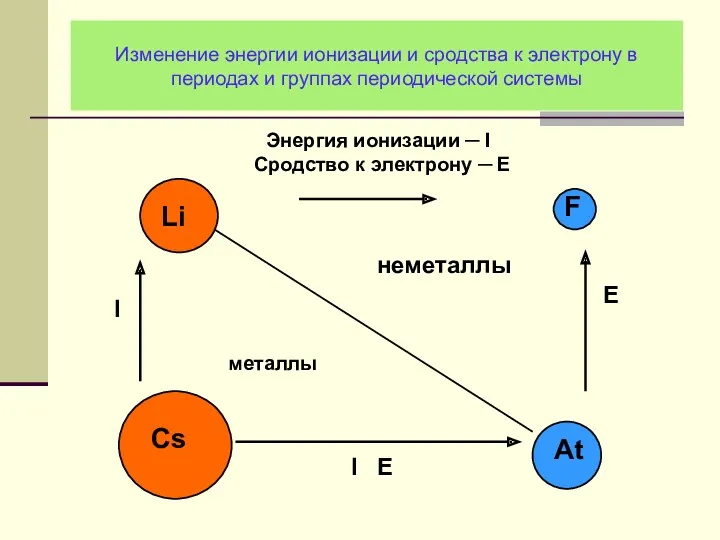
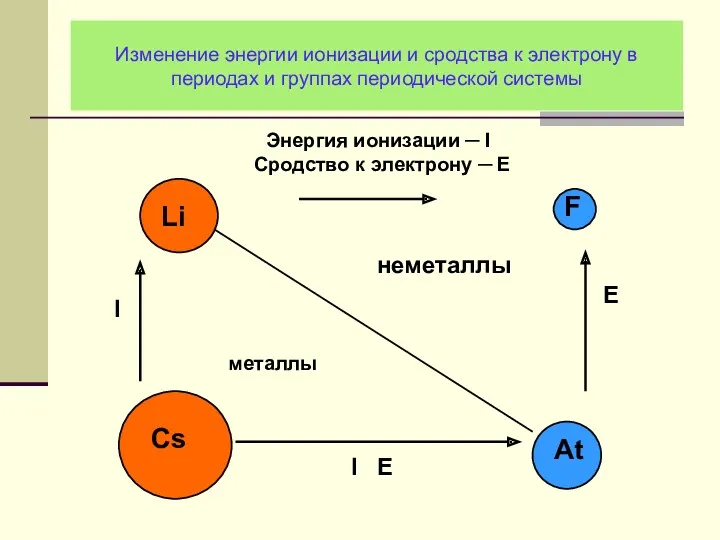
- 11. Изменение энергии ионизации и сродства к электрону в периодах и группах периодической системы
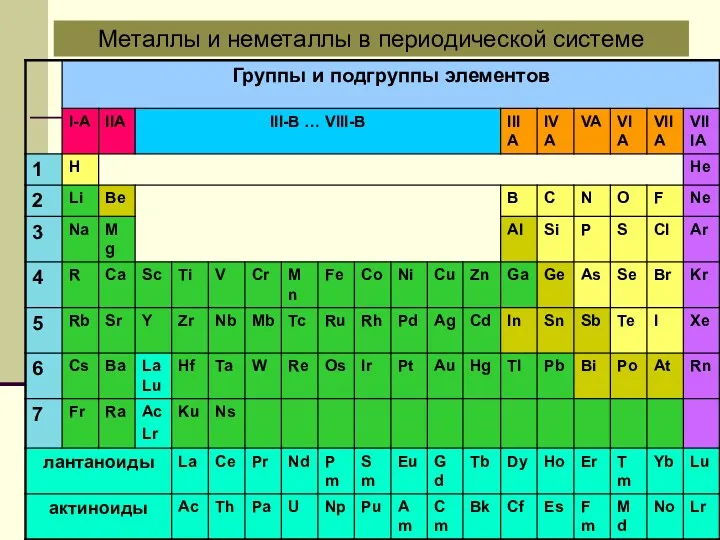
- 12. Металлы и неметаллы в периодической системе
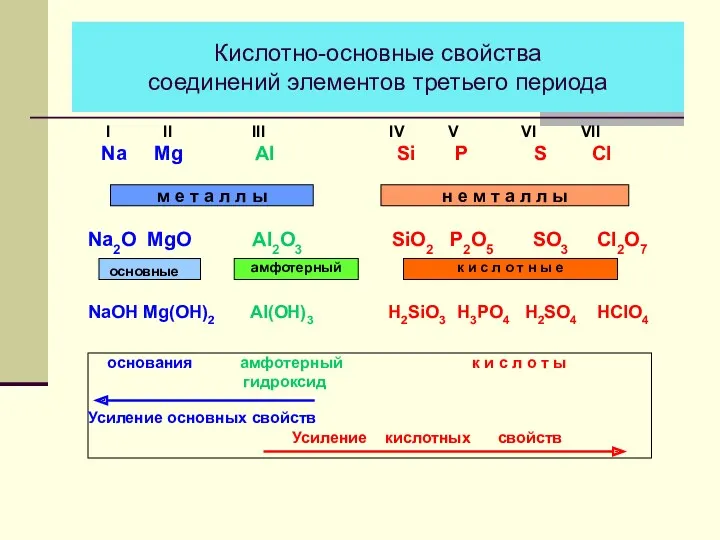
- 13. Кислотно-основные свойства соединений элементов третьего периода
- 14. Химическая связь Литература Коровин Н.В. Общая химия. – М.: Высш. шк., 2000. ─ 558 с. §§
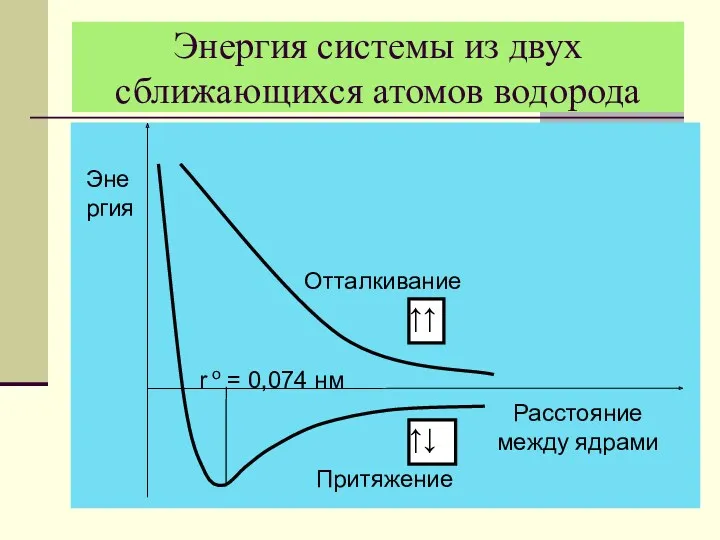
- 15. Энергия системы из двух сближающихся атомов водорода
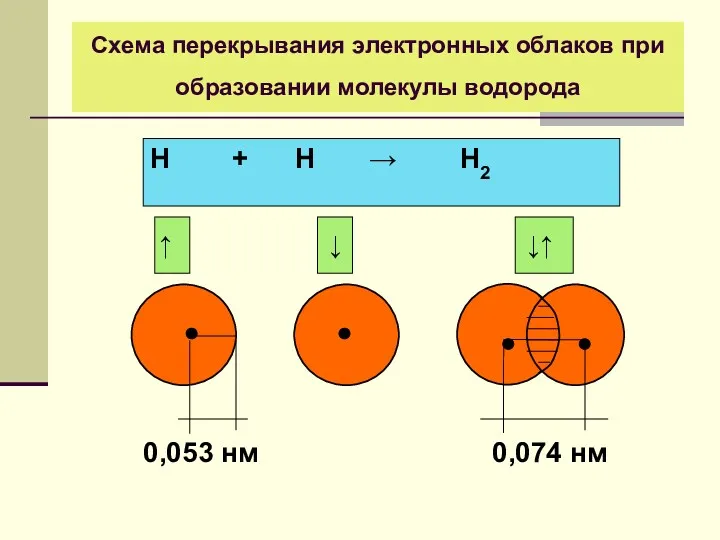
- 16. Схема перекрывания электронных облаков при образовании молекулы водорода
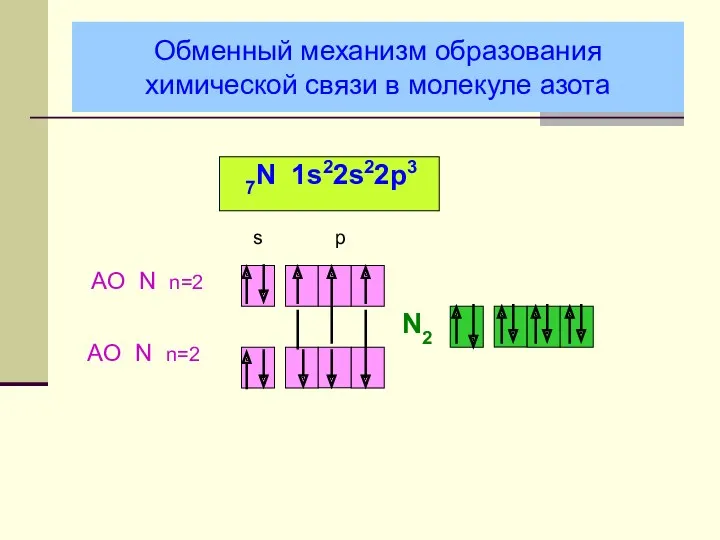
- 17. Обменный механизм образования химической связи в молекуле азота
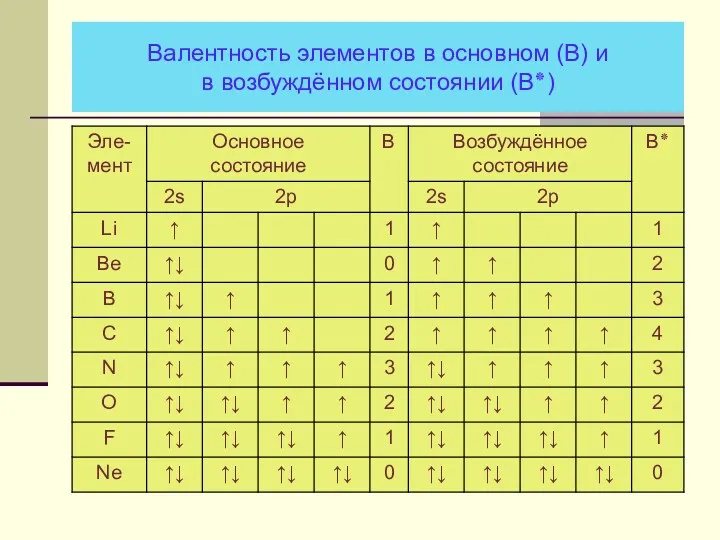
- 18. Валентность элементов в основном (В) и в возбуждённом состоянии (В٭)
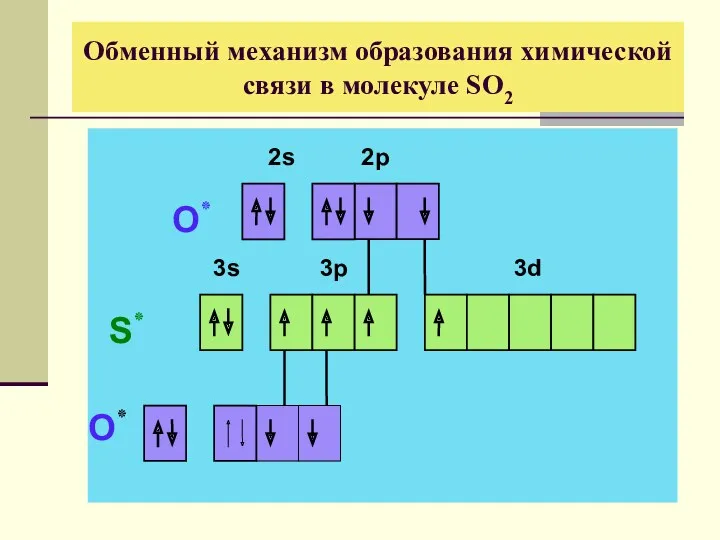
- 19. Обменный механизм образования химической связи в молекуле SO2
- 20. Донорно-акцепторный механизм образования ковалентной связи в ионе [NH4]+
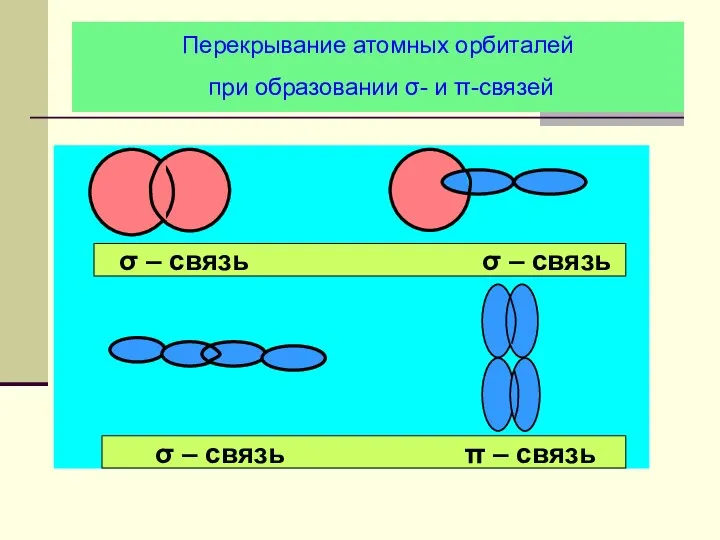
- 21. Перекрывание атомных орбиталей при образовании σ- и π-связей
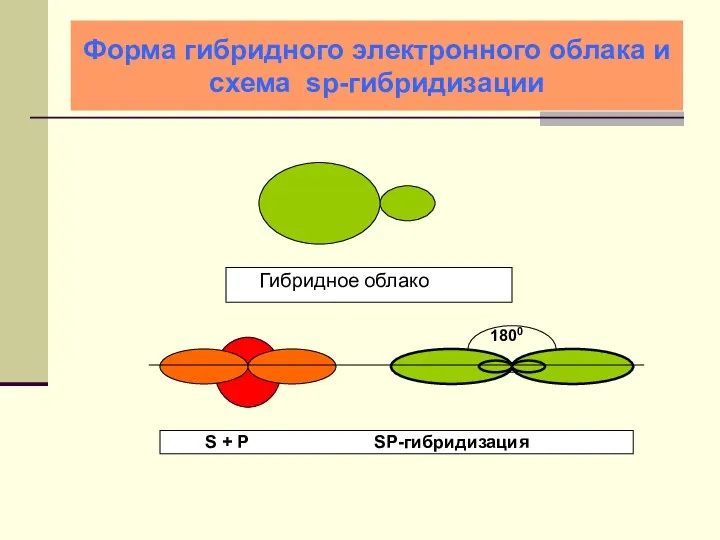
- 22. Форма гибридного электронного облака и схема sp-гибридизации
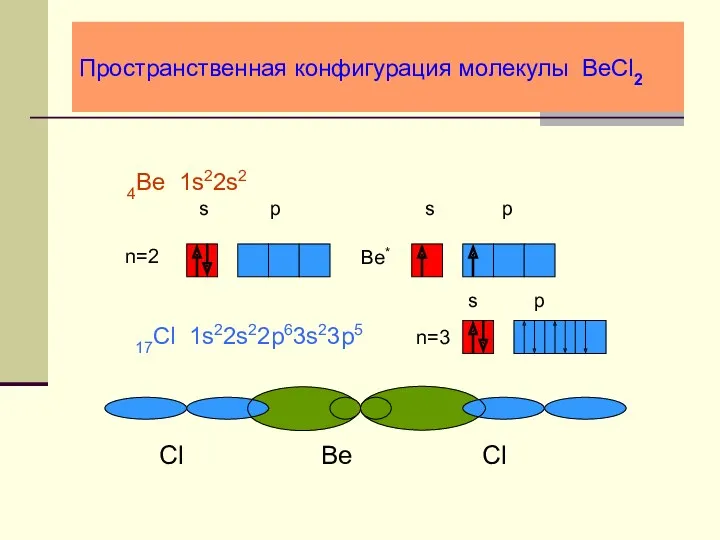
- 23. Пространственная конфигурация молекулы BeCl2
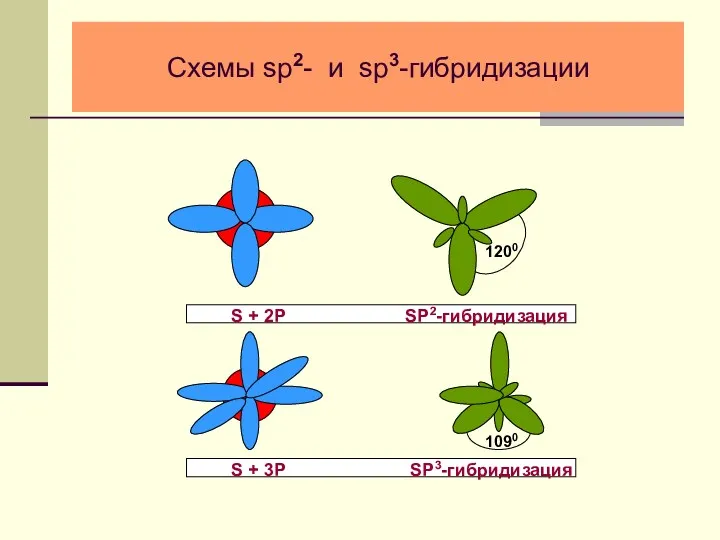
- 24. Схемы sp2- и sp3-гибридизации
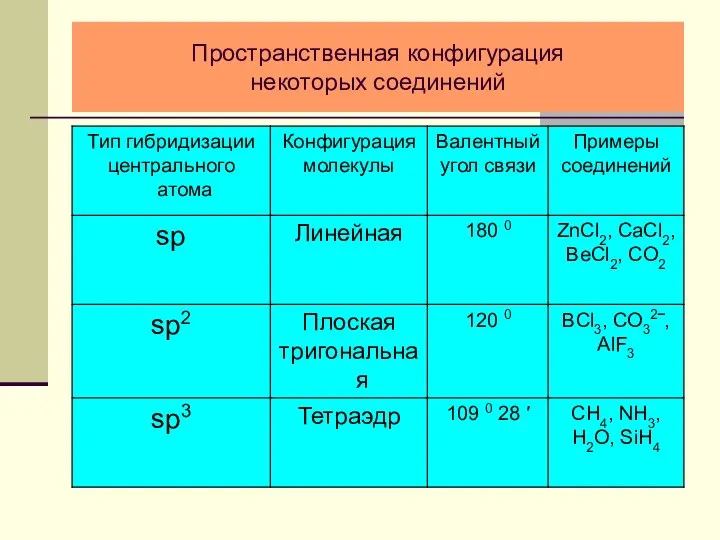
- 25. Пространственная конфигурация некоторых соединений
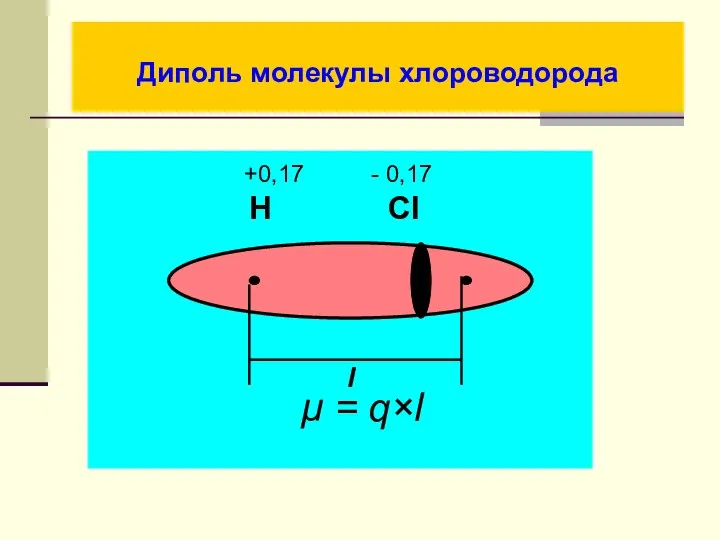
- 26. Диполь молекулы хлороводорода
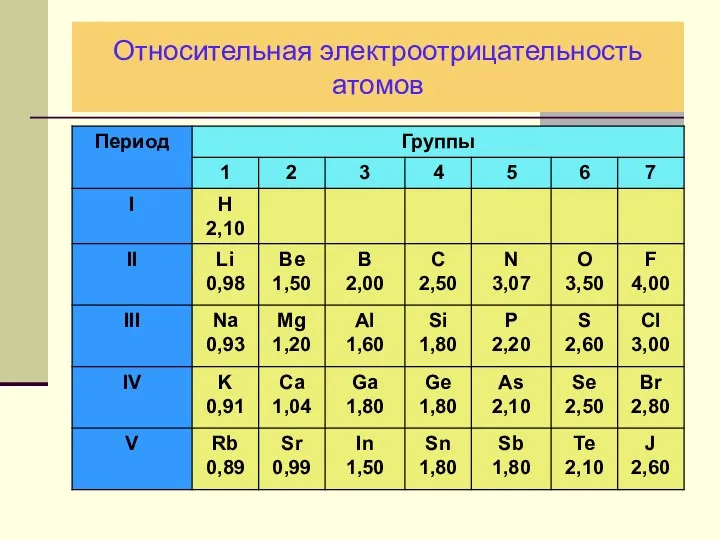
- 27. Относительная электроотрицательность атомов
- 28. Изменение энергии ионизации и сродства к электрону в периодах и группах периодической системы
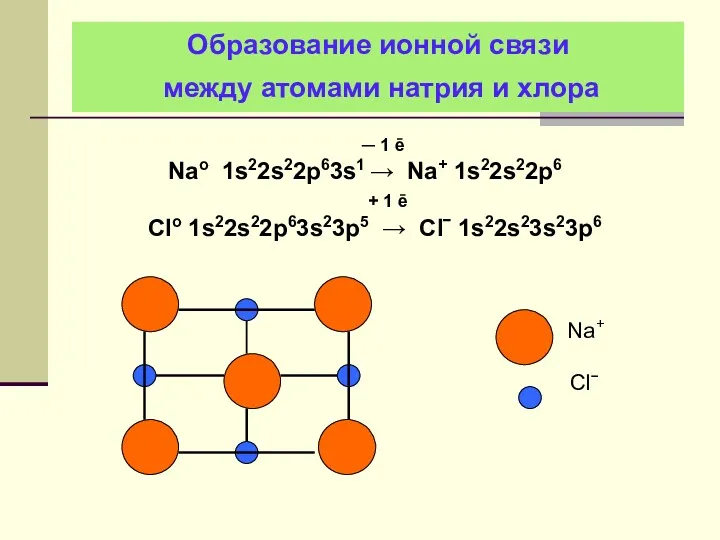
- 29. Образование ионной связи между атомами натрия и хлора
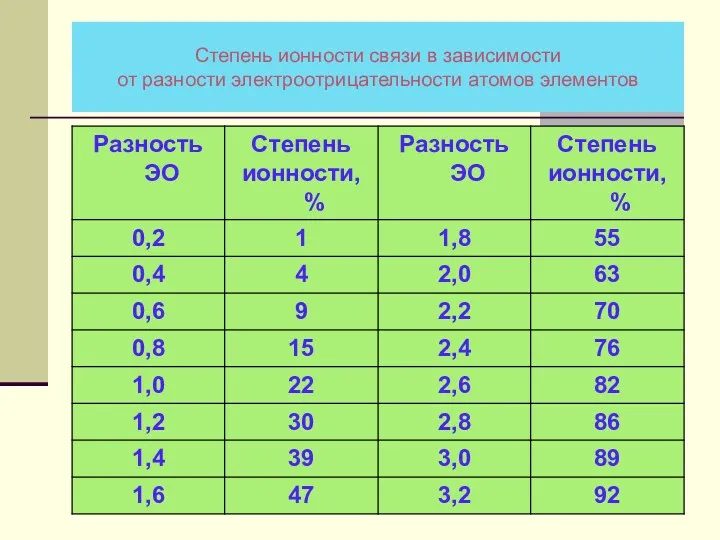
- 30. Степень ионности связи в зависимости от разности электроотрицательности атомов элементов
- 31. Линейная комбинация АО (метод ЛКАО) ψАВ = аψА ± bψВ ψАВ ─ волновая функция электрона в
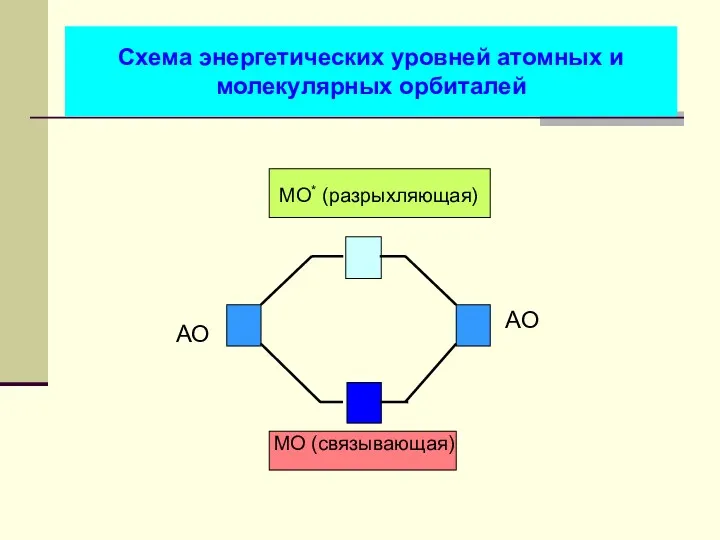
- 32. Схема энергетических уровней атомных и молекулярных орбиталей
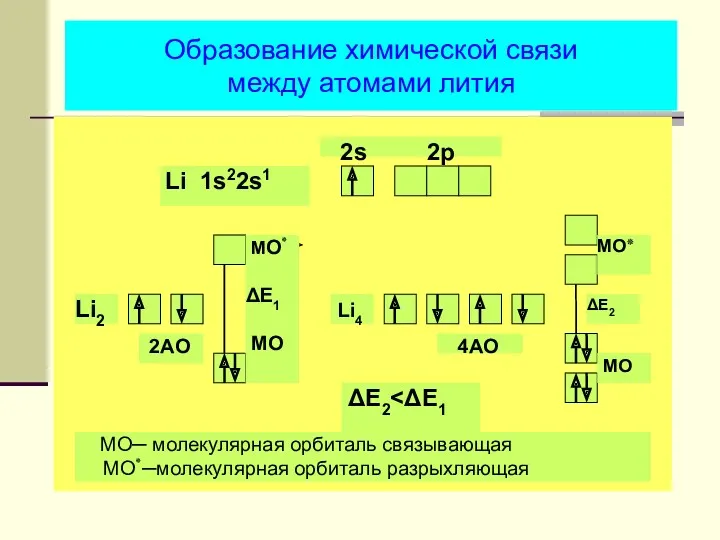
- 33. Образование химической связи между атомами лития
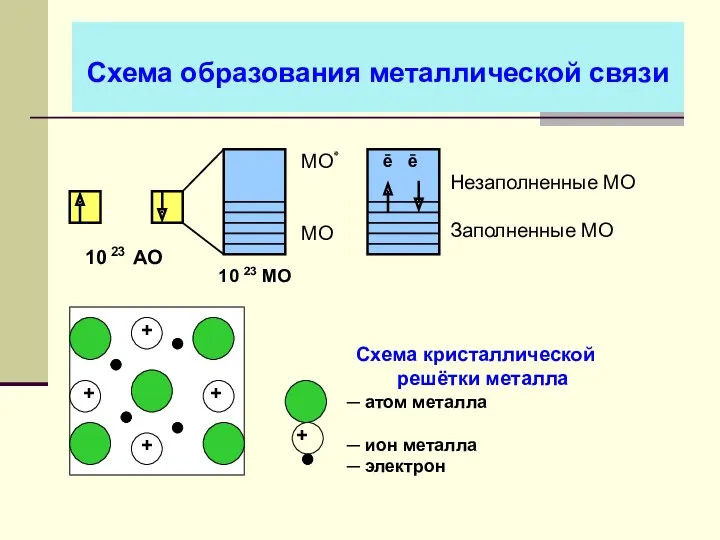
- 34. Схема образования металлической связи
- 36. Скачать презентацию





![Донорно-акцепторный механизм образования ковалентной связи в ионе [NH4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/334810/slide-19.jpg)

 Биоорганическая химия
Биоорганическая химия Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Материалы и изделия на основе полимеров. Лекция 16
Материалы и изделия на основе полимеров. Лекция 16 Редокс – тепе-теңдік және процестері
Редокс – тепе-теңдік және процестері Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Nitraty
Nitraty бензол
бензол Польза и вред химического производства
Польза и вред химического производства Целлюлоза
Целлюлоза Йод. Химические свойства
Йод. Химические свойства Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Гидроксид железа
Гидроксид железа Применение уксусной кислоты
Применение уксусной кислоты Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Камни и минералы
Камни и минералы Кислоты, их классификация и свойства в свете ТЭД
Кислоты, их классификация и свойства в свете ТЭД Моноядерні арени
Моноядерні арени Фенолы+
Фенолы+ Аналитическая химия
Аналитическая химия Аммиак. 9 класс
Аммиак. 9 класс Ионные уравнения
Ионные уравнения Природные источники углеводородов
Природные источники углеводородов