Содержание
- 2. Для ученика: Познакомиться с различными классификациями кислот и выяснить, какие общие химические свойства для них характерны.
- 3. Определения Кислоты – сложные вещества, молекулы который состоят из атомов водорода и кислотного остатка Кислоты –
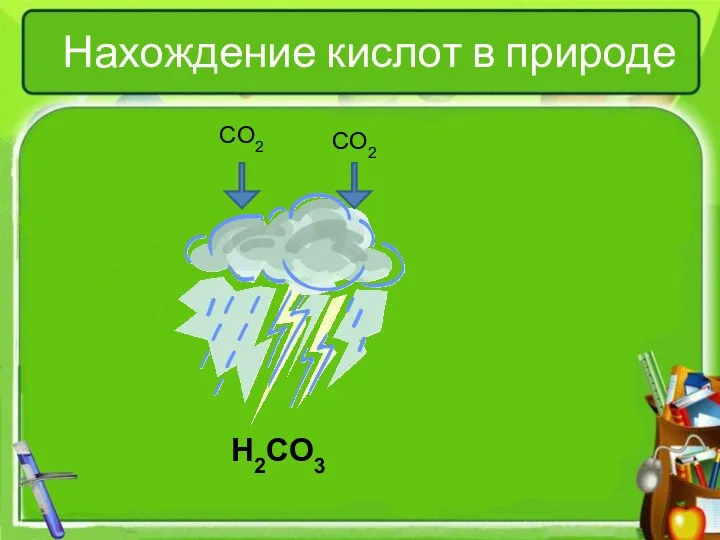
- 4. Нахождение кислот в природе CO2 CO2 H2CO3
- 5. Нахождение кислот в природе HNO3
- 6. Вопрос для любознательных: В какой климатической зоне образуется больше азотной кислоты естественного происхождения: у нас в
- 7. Нахождение кислот в природе H2SO4
- 8. Вопрос для экологов: К каким негативным последствиям приводит выпадение кислотных осадков?
- 9. Нахождение кислот в природе
- 10. Нахождение кислот в природе Лимонная Яблочная
- 11. Кислоты в быту
- 12. Кислоты в продуктах питания Молочная кислота
- 13. Кислоты в продуктах питания H3PO4 (Е338)
- 14. Вопрос для заботящихся о своем здоровье: К каким негативным последствиям может привести чрезмерное употребление в пищу
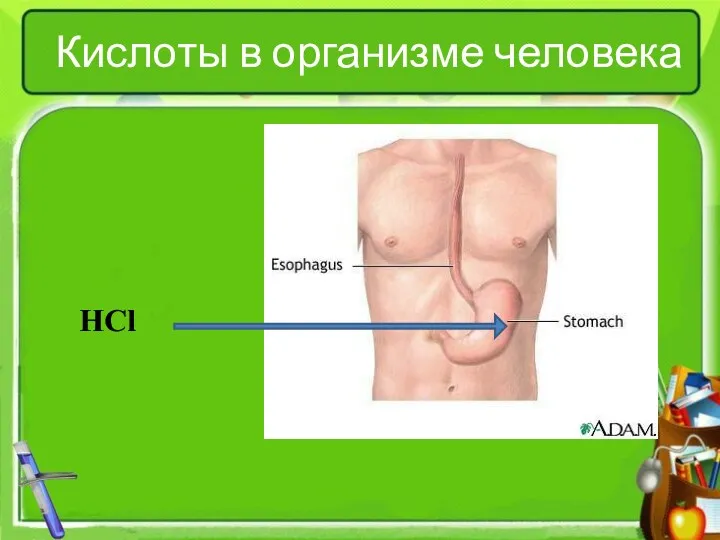
- 15. Кислоты в организме человека HCl
- 16. Вопрос для любознательных: За счет чего выживают птицы, питающиеся падалью, ведь в их организм попадают миллиарды
- 17. Классификации кислот Работа с учебником: Габриелян О.С. Химия-8 Табл. 10 с. 210 Рассмотрите первую колонку Табл.
- 18. Общие свойства кислот Изменение окраски индикаторов в растворах кислот Вывод: общие свойства кислот (кислый вкус, изменение
- 19. Домашний эксперимент для любознательных: Соблюдайте правила по ТБ! Осторожно обращайтесь с кислотами! Приготовьте 2 стакана черного
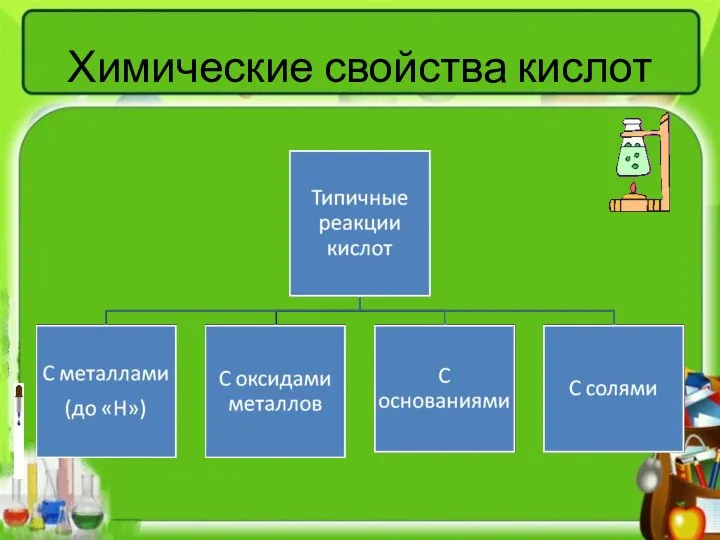
- 20. Химические свойства кислот
- 21. Химические свойства кислот Кислота + Ме (до «Н») = соль + Н2 (р-ция замещения) Zn +
- 22. Химические свойства кислот Кислота + основание = соль + вода (р-ция нейтрализации) H2SO4 + 2NaOH =
- 23. Домашний эксперимент для любознательных: На дно химического стакана насыпьте немного лимонной кислоты. Добавьте к ней пищевой
- 24. Проверьте ваши знания Закончите молекулярные уравнения возможных реакций и запишите соответствующие им ионные уравнения HCl +
- 26. Скачать презентацию




















 Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Иондық байланыс
Иондық байланыс Кінетика хімічних реакцій і хімічна рівновага
Кінетика хімічних реакцій і хімічна рівновага Ізомери у природі
Ізомери у природі Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические Күрделі эфирлер
Күрделі эфирлер Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Неорганические вещества клетки
Неорганические вещества клетки Установка пиролиза широкой фракции, легких углеводородов
Установка пиролиза широкой фракции, легких углеводородов Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери
Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Массообменные процессы
Массообменные процессы Химия. D-элементтер
Химия. D-элементтер Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Пластмассы. Связующие вещества
Пластмассы. Связующие вещества Alkynes
Alkynes Водородные соединения неметаллов
Водородные соединения неметаллов Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Спирты
Спирты Озон
Озон Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды
Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Аммиак. Соли аммония
Аммиак. Соли аммония Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы