Содержание
- 2. 1.Важнейшее свойство живых систем заключается в их способности улавливать, преобразовывать и запасать энергию в различных формах.
- 3. Формулировка 1-го закона термодинамики для различных термодинамических систем В изолированной системе полный запас энергии – величина
- 4. Антуан Лоран Лавуазье (1743-1794) Пьер-Симон де Лаплас (1749-1827) Анри Лавуазье и Пьер Лаплас показали, что дыхание
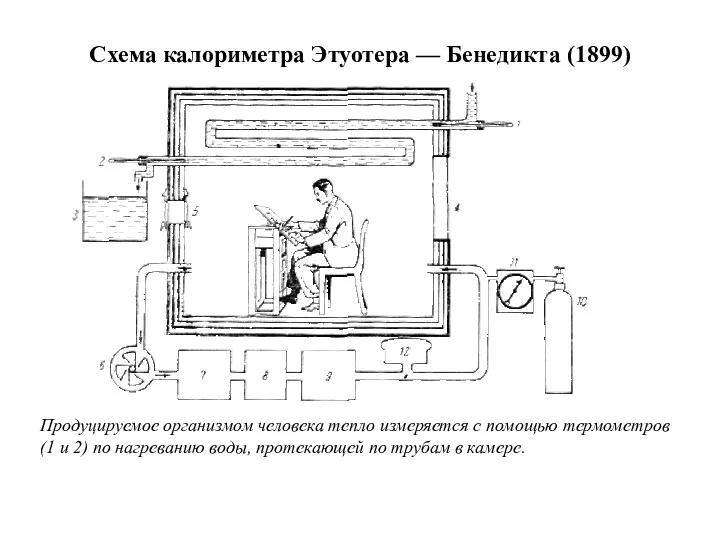
- 5. Схема калориметра Этуотера — Бенедикта (1899) Продуцируемое организмом человека тепло измеряется с помощью термометров (1 и
- 6. Живые организмы - открытые термодинамические системы, существующие в условиях постоянного давления и температуры. Поэтому для оценки
- 7. Второе начало термодинамики имеет несколько формулировок, но в главном – это фундаментальный закон монотонного возрастания энтропии.
- 8. 1850 г. - Немецкий физик Рудольф Клаузиус сформулировал второе начало термодинамики. «Теплота не может сама собою
- 9. Невозможен вечный двигатель 2-го рода, т.е. невозможна машина, которая изотермически превращала бы тепло в работу (У.Томсон)
- 10. Первый закон утверждает нас в мысли, что «нечто», называемое нами энергией, постоянно, второй же закон говорит
- 11. Под энтропией (S ) понимают количество теплоты, которое уже не может быть превращено в механическую работу.
- 12. 1.Энтропия – это физическая величина, характеризующая значение связанной энергии данной системы, приходящейся на единицу температуры (1К)
- 13. 1.На основе атомистической гипотезы и кинетической теории газов Больцман впервые дал физическую трактовку энтропии, исходя из
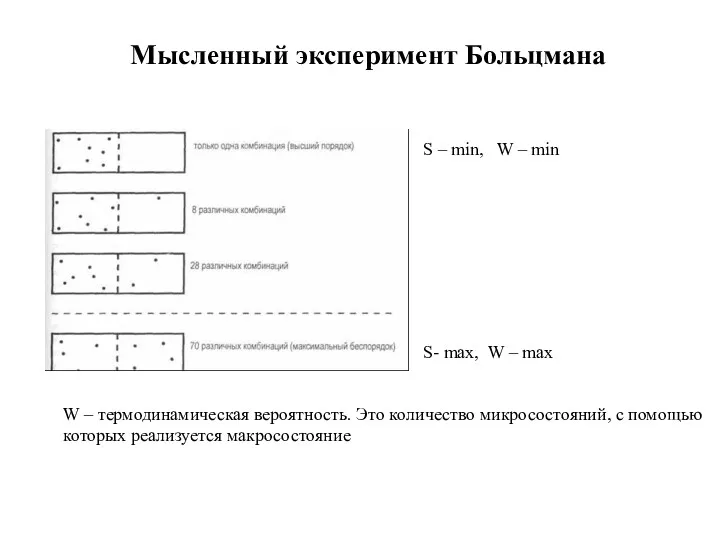
- 14. Мысленный эксперимент Больцмана S- max, W – max S – min, W – min W –
- 15. Энтропия (S) в статистической физике определяется как логарифмическая функция вероятности равновесного состояния системы частиц (для которых
- 16. Памятник Больцману на центральном кладбище Вены; на нем выгравировано соотношение Больцмана S = k⋅logW. (Работа Дитера
- 17. Живые организмы – открытые системы, и изменение энтропии для них складывается из: 1)продукции энтропии внутри организма
- 19. Скачать презентацию














 Процессы и операции формообразования. Неметаллические материалы
Процессы и операции формообразования. Неметаллические материалы 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Строение атома. 10 ен
Строение атома. 10 ен Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Қаныққан көмірсутектер. Алкандар және циклоалкандар
Қаныққан көмірсутектер. Алкандар және циклоалкандар Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Вода. Практическая работа
Вода. Практическая работа Теория электролитической диссоциации
Теория электролитической диссоциации Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Кристаллы, их свойства, получение, применение в природе и жизни человека
Кристаллы, их свойства, получение, применение в природе и жизни человека Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях ЕГЭ 2017. Подготовка к вопросу № 26
ЕГЭ 2017. Подготовка к вопросу № 26 Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Кислоты. Определение рН кислоты, щелочи, воды
Кислоты. Определение рН кислоты, щелочи, воды Классификация и свойства оксидов
Классификация и свойства оксидов Относительная молекулярная масса
Относительная молекулярная масса Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Классификация минералов
Классификация минералов Кобальт. Химический элемент
Кобальт. Химический элемент Строение атома
Строение атома Растворимость. Равновесие системы осадок-раствор
Растворимость. Равновесие системы осадок-раствор Көміртек
Көміртек Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Періодична система хімічних елементів
Періодична система хімічних елементів Твердые вещества
Твердые вещества Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1)