Содержание
- 2. Химический элемент – это… Атом – это ___________________ . Изотоп – это разновидность атома одного химического
- 3. Дмитрий Иванович Менделеев (1834-1907 ) Выдающийся русский химик, открывший периодический закон и создавший периодическую систему химических
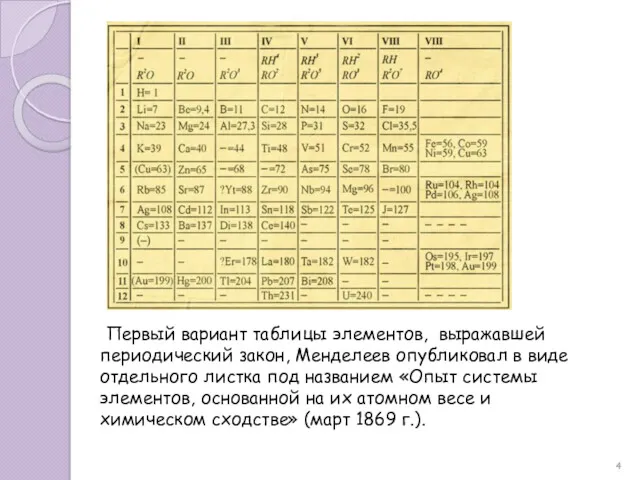
- 4. Первый вариант таблицы элементов, выражавшей периодический закон, Менделеев опубликовал в виде отдельного листка под названием «Опыт
- 5. 03.09.2015 Современная периодическая таблица Д.И.Менделеева
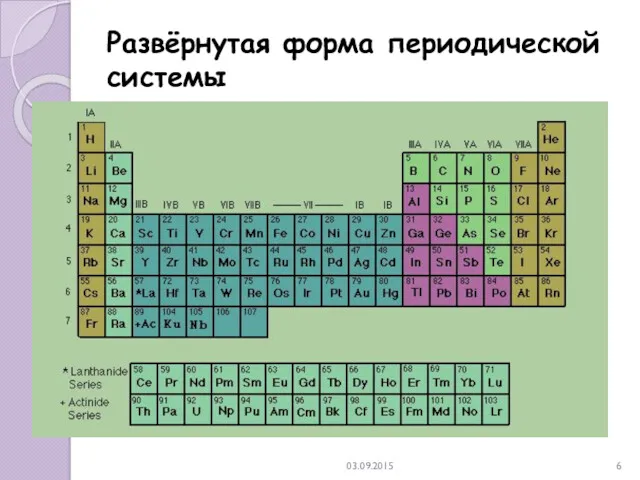
- 6. 03.09.2015 Развёрнутая форма периодической системы
- 7. Структура периодической системы: Формулировка периодического закона «Свойства химических элементов и их соединений находятся в периодической зависимости
- 8. 03.09.2015 Структура периодической системы: Понятие группы А) Группа – это расположение элементов по вертикали. Б) В
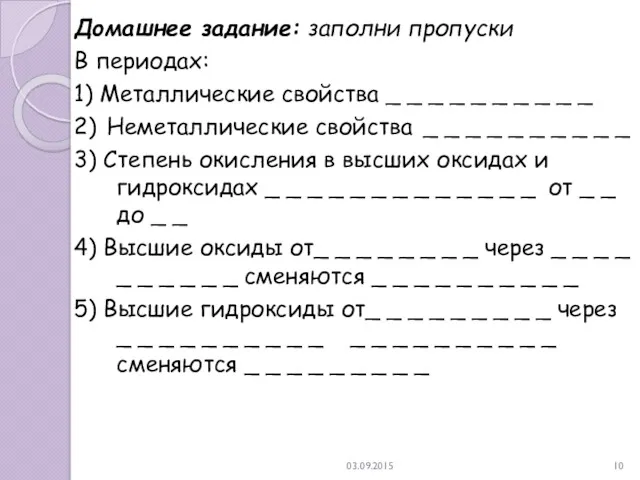
- 10. 03.09.2015 Домашнее задание: заполни пропуски В периодах: 1) Металлические свойства _ _ _ _ _ _
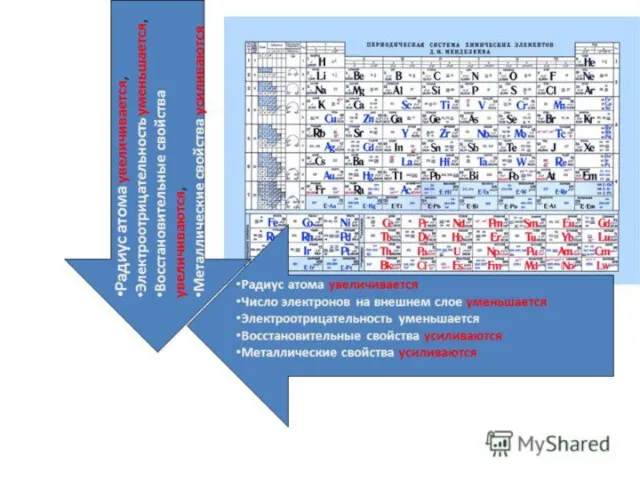
- 11. 03.09.2015 Домашнее задание: впиши пропущенные слова В пределах одного периода с увеличением порядкового номера элемента металлические
- 12. 03.09.2015 Домашнее задание: впиши пропущенные слова В пределах одной группы (главной подгруппы) с увеличением порядкового номера
- 13. 03.09.2015 План характеристики химического элемента: 1. Положение в ПСХЭ: -Порядковый номер - Номер периода -Номер группы
- 14. ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ПО ПОЛОЖЕНИЮ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА 3115 Р – 3 период, VA группа
- 15. 03.09.2015 Задание: подчеркните символы химических элементов-металлов и расположите их в порядке ослабления металлических свойств: А) Cl;
- 16. 03.09.2015 Задание: подчеркните символы химических элементов-неметаллов и расположите их в порядке усиления неметаллических свойств: А) Li;
- 17. 03.09.2015 Задание. Расположи химические элементы в порядке возрастания - неметаллических свойств: а) P; S; Si. б)
- 18. 03.09.2015 Задание: Сравните атомы поставив знаки ›, ‹ или = : А) заряд ядра: Al …
- 20. Скачать презентацию













 Термодинамика химических процессов
Термодинамика химических процессов Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ Оксиды и гидроксиды щелочных металлов
Оксиды и гидроксиды щелочных металлов Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Щелочноземельные металлы
Щелочноземельные металлы Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация
Строение атома. Периодический закон и система элементов Д.И. Менделеева. Химическая связь. Гибридизация Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Nucleic acids
Nucleic acids Кремний и его соединения. 9 класс
Кремний и его соединения. 9 класс 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Природные источники углеводородов
Природные источники углеводородов Классификация химических реакций
Классификация химических реакций Спирты. Классификация спиртов
Спирты. Классификация спиртов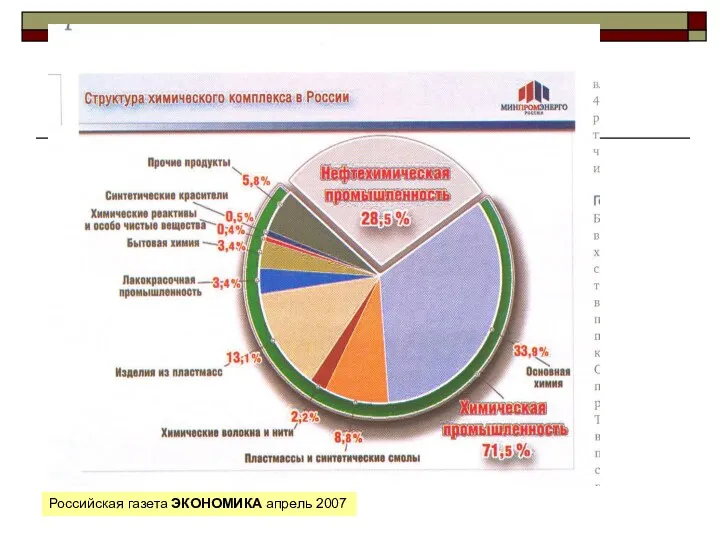 Свойства и классификация нефти
Свойства и классификация нефти АЛКАНЫ 9 класс
АЛКАНЫ 9 класс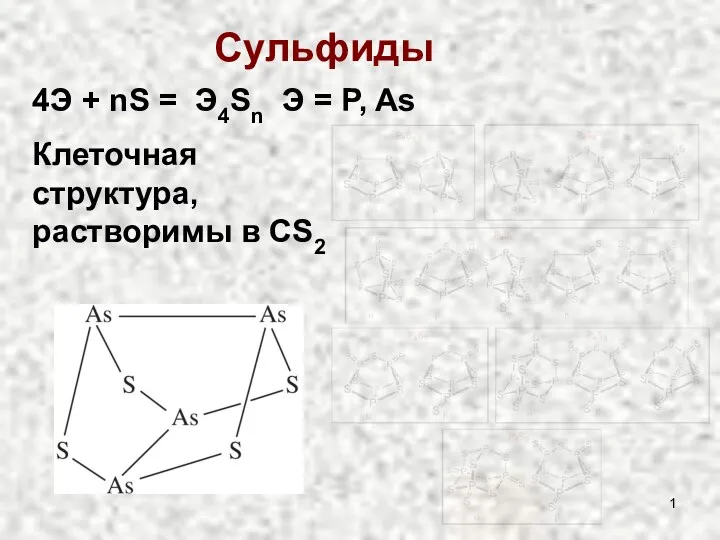 Сульфиды и оксиды
Сульфиды и оксиды Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции
Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Оксид водорода (H2O)
Оксид водорода (H2O) Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Железо. Соединения железа
Железо. Соединения железа Характеристика спиртов
Характеристика спиртов Кaрбоновые кислоты
Кaрбоновые кислоты Класи неорганічних сполук
Класи неорганічних сполук