Содержание
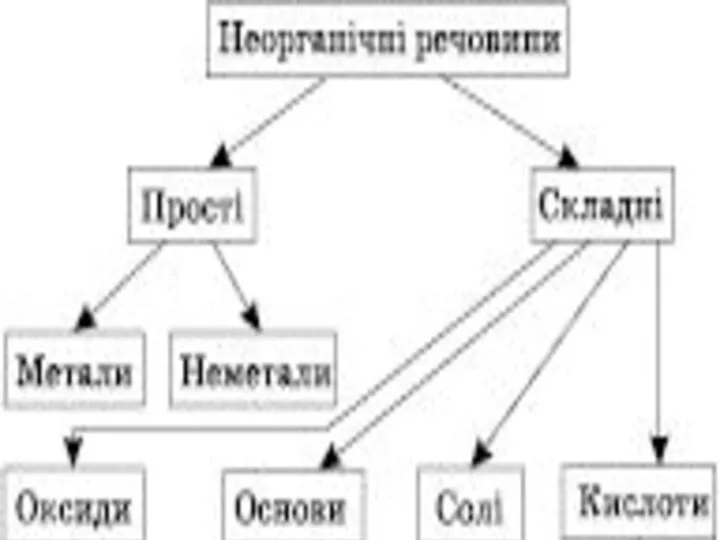
- 2. План Оксиди. 2. Основи. 3. Кислоти. 4. Солі.
- 4. Солетворні Основні (CaO, FeO) Кислотні (CO2, P2O5) Амфотерні (ZnO, Al2O3) Несолетворні (SiO2, CO, N2O) Класифікація оксидів
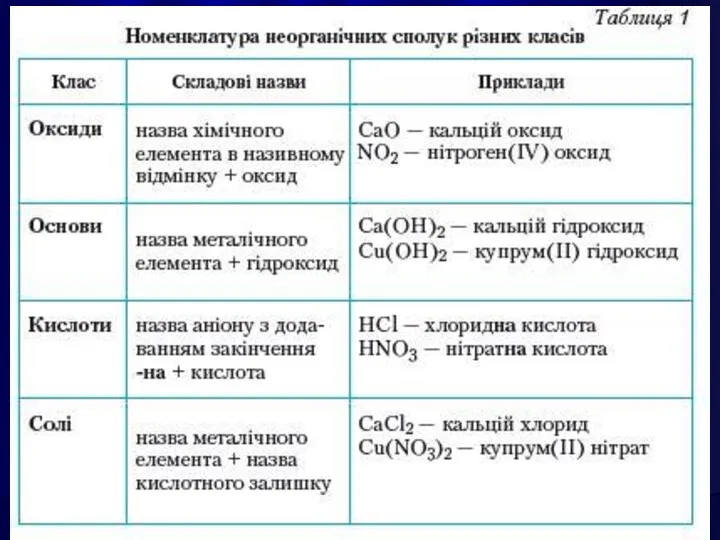
- 5. Окси́д — бінарна сполука, до складу якої входить Оксиген. Майже всі елементи утворюють оксиди. Їх загальні
- 6. Назва оксидів складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини,
- 8. ОСНОВНИМИ_ОКСИДАМИ називають оксиди металів, гідрати яких є основами. Наприклад: Lі2O, Nа2O, К2O, Rb2O, CS2O, MgO, CaO,
- 9. КИСЛОТНИМИ_ОКСИДАМИ називають оксиди, гідрати яких є кислотами. Наприклад: Ва2О3, СО2, М2О5, Р2О5, С12О7, СrО3, V2O5, МnО3,
- 10. АМФОТЕРНИМИ_ОКСИДАМИ називають оксиди, гідрати яких є амфотерними гідроксидами. Наприклад: А12О3, Сг2О3, ВеО, ZnО, SnО, Sn02, РbО,
- 11. Методи одержання оксидів Безпосереднім сполученням елементів з киснем: 2Zn + O2 = 2ZnO 4Р + 5О2
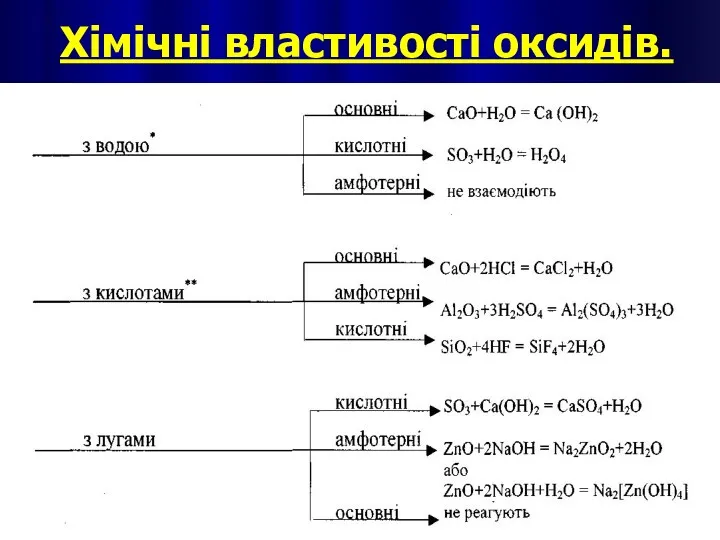
- 12. Хімічні властивості оксидів.
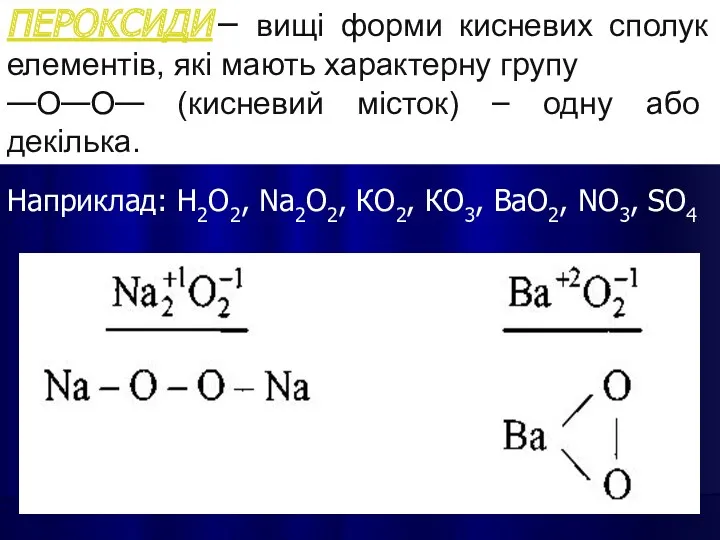
- 13. ПЕРОКСИДИ – вищі форми кисневих сполук елементів, які мають характерну групу —О—О— (кисневий місток) – одну
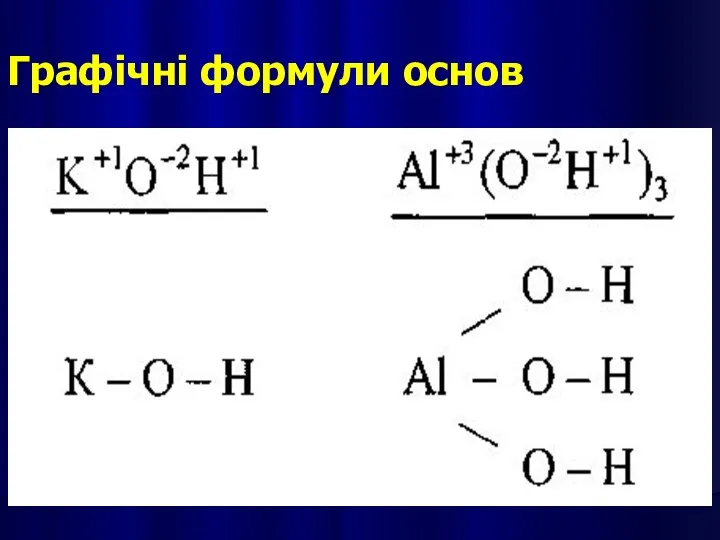
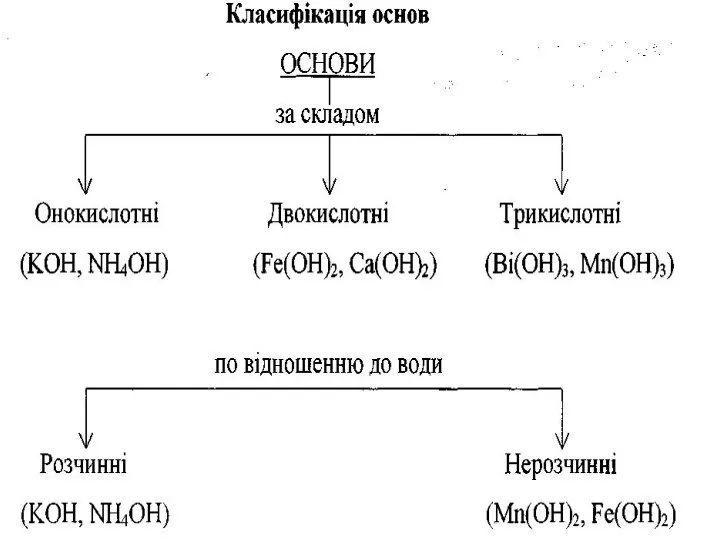
- 14. ОСНОВАМИ є сполуки основних оксидів з водою, які мають гідроксильні групи —ОН. Назви основ: після слова
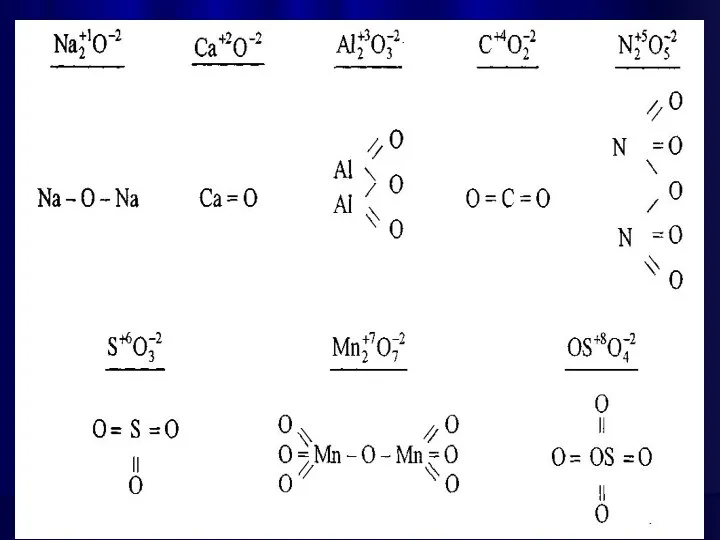
- 15. Наприклад:
- 16. Графічні формули основ
- 18. Основи можна добути різними способами. Безпосереднім сполученням основних оксидів з водою. Na2O + H2O = 2NaOH
- 19. Хімічні властивості основ 1. Взаємодія основ з кислотними оксидами. 1. Взаємодія основ з кислотними оксидами. 2.
- 20. 3. Взаємодія лугів з амфотерними оксидами. 4. Взаємодія лугів з амфотерними гідроксидами. 5. Взаємодія лугів з
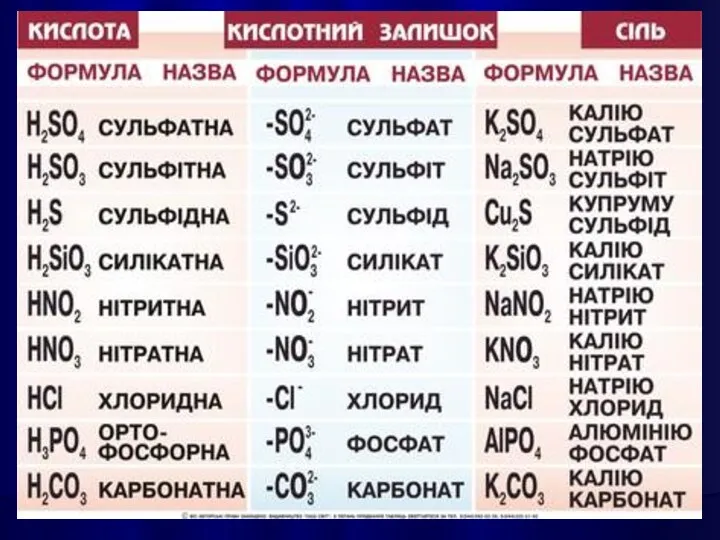
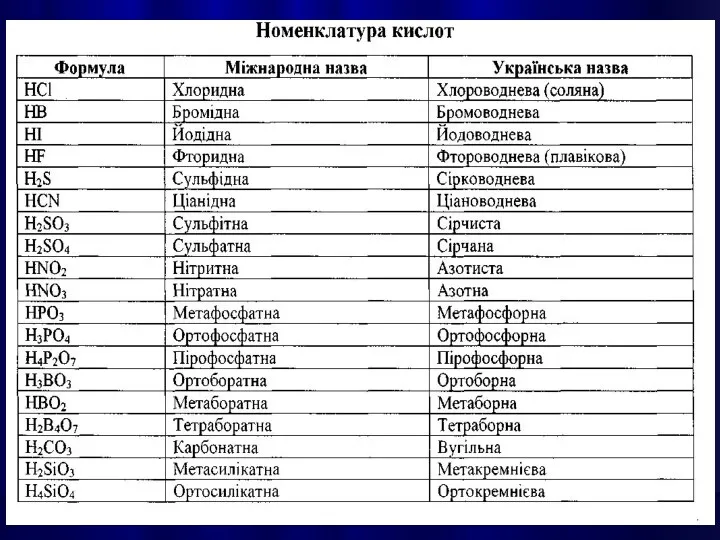
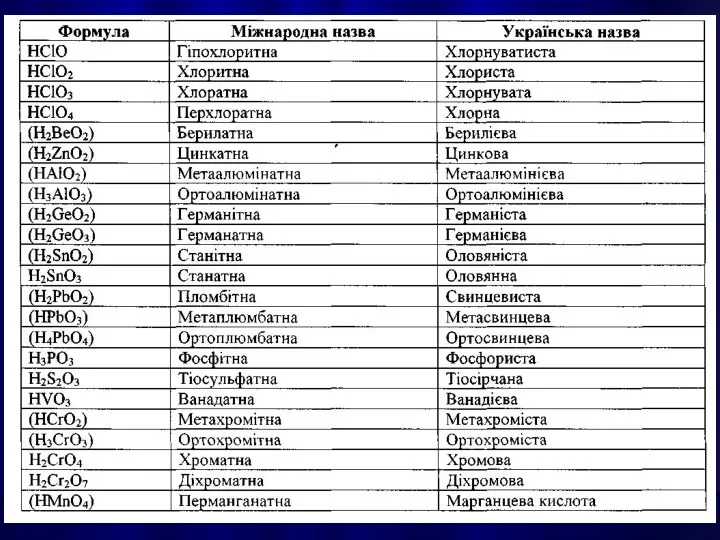
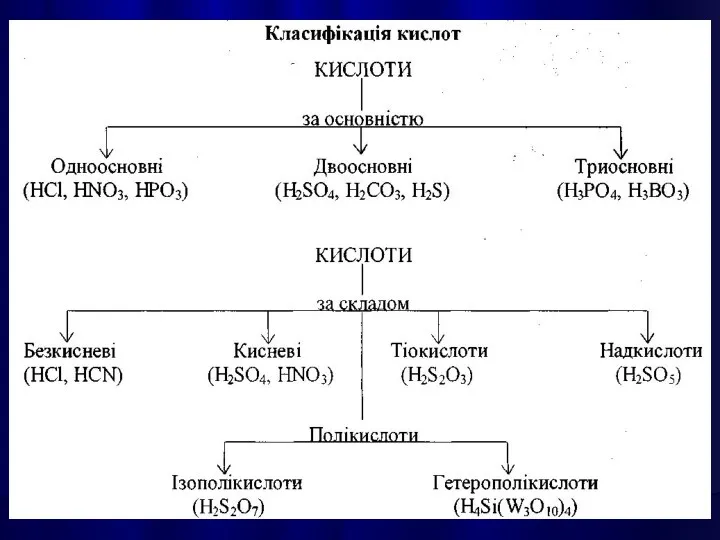
- 21. КИСЛОТАМИ називають сполуки, які містять атоми Гідрогену, здатні заміщуватися на метал з утворенням солей.
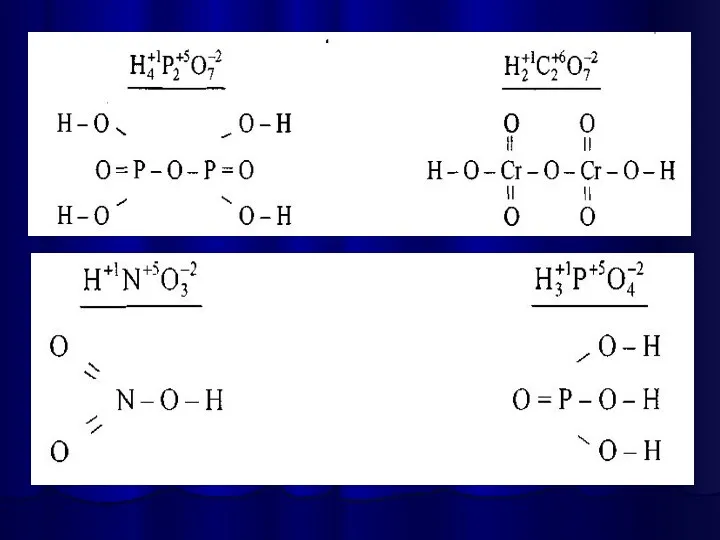
- 25. Написання графічної формули кислоти починають з кислотоутворюючого елементу, потім справа від нього пишуть стільки груп —ОН,
- 28. Кислоти можна добувати різними способами. Безпосереднім сполученням ангідридів з водою: SO3 + Н2О = Н2SO4 N2O5
- 29. 3. Безкисневі кислоти можна одержувати як їх витісненням з солей іншими кислотами, так і безпосереднім сполученням
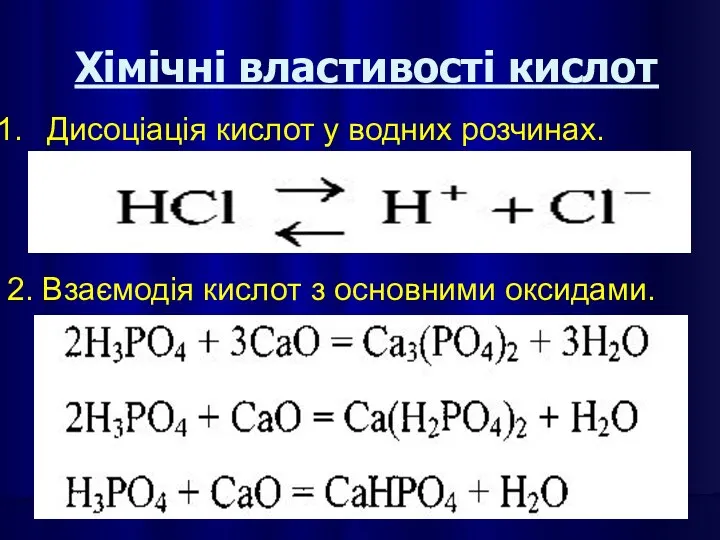
- 30. Хімічні властивості кислот Дисоціація кислот у водних розчинах. 2. Взаємодія кислот з основними оксидами.
- 31. 3. Взаємодія кислот з основами (реакція нейтралізації). 4. Взаємодія кислот з амфотерними оксидами та гідроксидами.
- 32. 5. Взаємодія кислот з солями 6. Взаємодія кислот з металами.
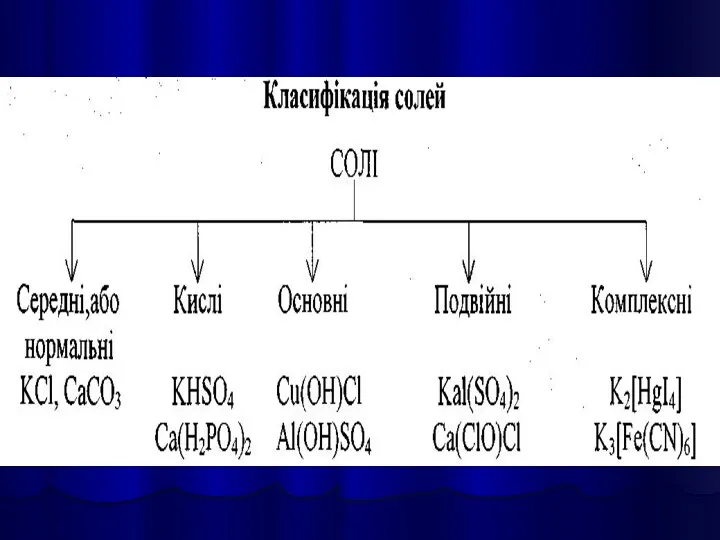
- 33. СОЛЯМИ є кристалічні речовини, які можна рахувати продуктами повного або часткового зміщення атомів Гідрогену в молекулах
- 35. Середні солі можна розглядати як продукти повного заміщення атомів Гідрогену в молекулі кислоти на метал, або
- 37. Солі утворюються: 1. При взаємодії кислот з основами (реакції нейтралізації): 2HNO3 + Ba(OH)2 = Ba(NO3)2 +
- 38. 4. При взаємодії кислот з солями: 3H2SO4 + Ca3(PO4)2 = 2H3PO4 + 3CaSO4 ↓ 5. При
- 39. 8. При взаємодії основних оксидів з кислотними: CaO + CO2 = CaCO3 9. При взаємодії солей:
- 40. Хімічні властивості солей 1. Дисоціація солей у водних розчинах. 2. Гідроліз солей – взаємодія солі з
- 41. 3. Взаємодія солей з лугами (розчинними основами): 4. Взаємодія солей з кислотами: 5. Взаємодія між солями.
- 44. Скачать презентацию



























 Свойства простых веществ в свете ОВР
Свойства простых веществ в свете ОВР Уход за волосами
Уход за волосами Характеристика элементов VIII-Б группы. Семейство железа
Характеристика элементов VIII-Б группы. Семейство железа Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Кислоты
Кислоты Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11) Карбоновые кислоты. Классификация карбоновых кислот
Карбоновые кислоты. Классификация карбоновых кислот Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Кремний и его соединения
Кремний и его соединения Фенол. Состав молекулы фенола
Фенол. Состав молекулы фенола История хроматографии. Виды хроматографических методов
История хроматографии. Виды хроматографических методов Склад і основні фізико-хімічні властивості молочного білку
Склад і основні фізико-хімічні властивості молочного білку Обмен липидов
Обмен липидов Oxygen, O2
Oxygen, O2 Изомеры – это вещества, имеющие одинаковый состав
Изомеры – это вещества, имеющие одинаковый состав Химическое равновесие
Химическое равновесие Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Основы коррозии и защиты металлов. Методы исследования коррозии
Основы коррозии и защиты металлов. Методы исследования коррозии Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы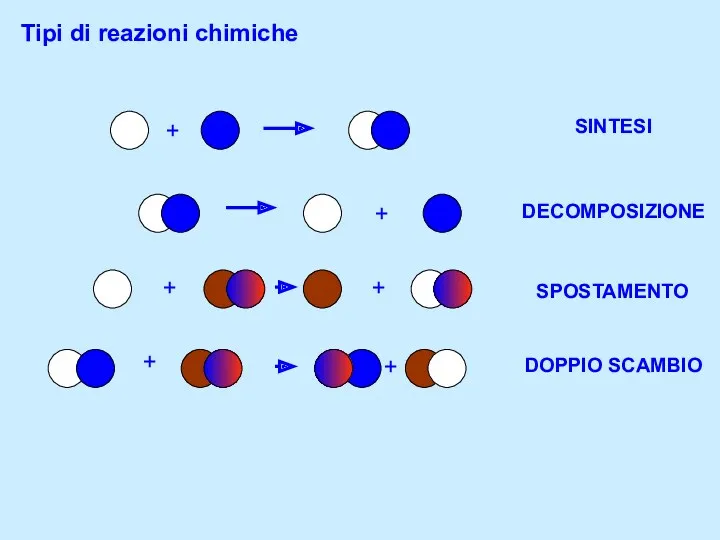 Tipi di reazioni chimiche
Tipi di reazioni chimiche Изомерия и ее виды
Изомерия и ее виды Диссоциация электролитов
Диссоциация электролитов