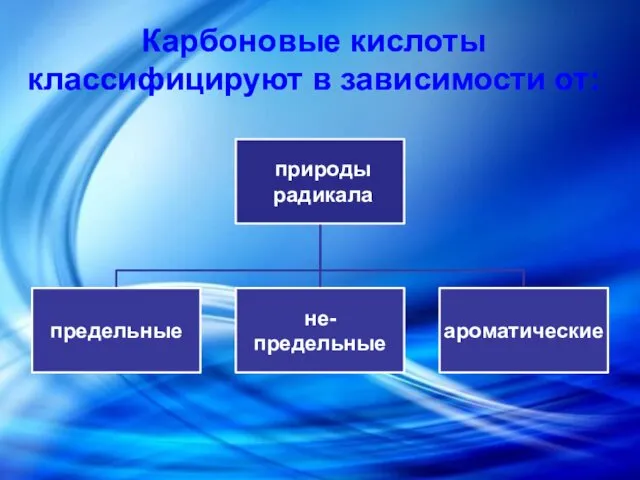
Химические свойства.
Взаимодействие с
металлами (до водорода)
2HCOOH + Mg (HCOO)2Mg +
H2↑
основными и амфотерными оксидами
2HCOOH + MgO (HCOO)2Mg + H2O
основаниями и амфотерными гидроксидами
2HCOOH + Mg(OH)2 (HCOO)2Mg + 2H2O
солями
2HCOOH + Na2SiO3 2HCOONa + H2SiO3↓
2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2↑
Органические кислоты вступают в реакцию этерификациии со спиртами,
образуя сложные эфиры, согласно уравнению
R C + H OR′ = R C + H2O
O
OH
O
O R′
кислота спирт сложный эфир
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
уксусная кислота этиловый спирт этилацетат





 Спирти. Феноли. Етери
Спирти. Феноли. Етери Мир кристаллов
Мир кристаллов Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические Переработка угля
Переработка угля Цинк
Цинк Методи отримання основних класів неорганічних сполук
Методи отримання основних класів неорганічних сполук Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Хімічні формули речовин
Хімічні формули речовин Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Биохимия. Лекция 7. Углеводы
Биохимия. Лекция 7. Углеводы Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Ароматические кислоты и их соли
Ароматические кислоты и их соли Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Азот в нашей жизни
Азот в нашей жизни Изменение агрегатных состояний вещества. 8 класс
Изменение агрегатных состояний вещества. 8 класс Білки (протеїни)
Білки (протеїни) Азотсодержащие органические соединения. Амины (часть 1)
Азотсодержащие органические соединения. Амины (часть 1) Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Кислоты. Определение и классификация
Кислоты. Определение и классификация Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе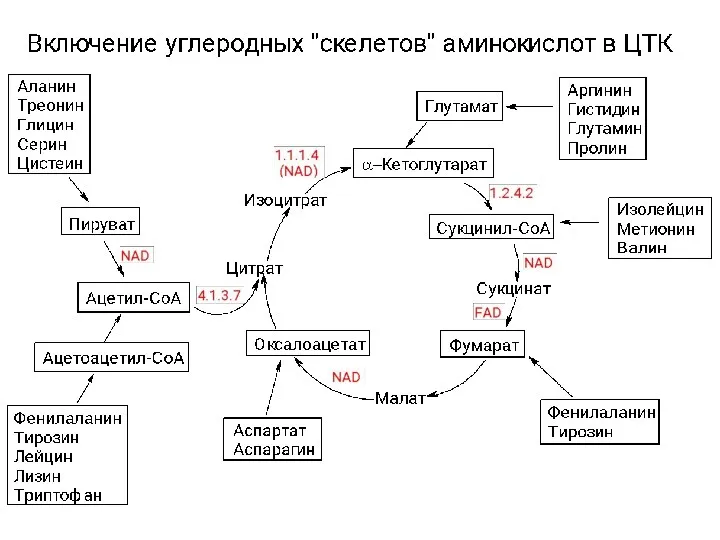 Катаболизм аминокислот
Катаболизм аминокислот Основы химической кинетики
Основы химической кинетики Введение в геохимию
Введение в геохимию Масова частка розчиненої речовини
Масова частка розчиненої речовини