Содержание
- 2. ПЛАН Классификация химических реакций Скорость химической реакции Закон действующих масс. Порядок реакции и молекулярность Влияние температуры
- 3. ХИМИЧЕСКАЯ КИНЕТИКА – (от греч. κίνησις – движущий) - наука о скоростях и закономерностях протекания химических
- 4. КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО МЕХАНИЗМУ Простые реакции протекают в одну стадию в соответствии со стехиометрическим уравнением. Такие
- 5. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Гомогенные- реакции в которых реагенты находятся в одном агрегатном состоянии; Гетерогенные- реакции в
- 6. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Под скоростью химической реакции понимается число элементарных актов взаимодействия реагентов в единицу времени,
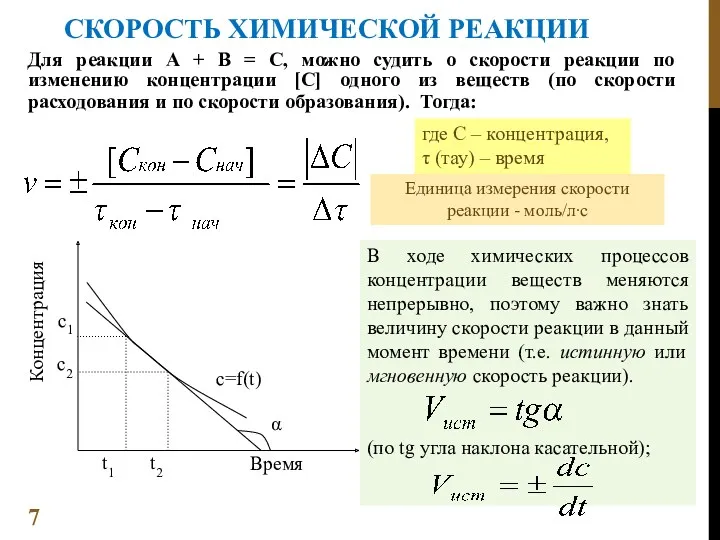
- 7. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Для реакции А + В = С, можно судить о скорости реакции по
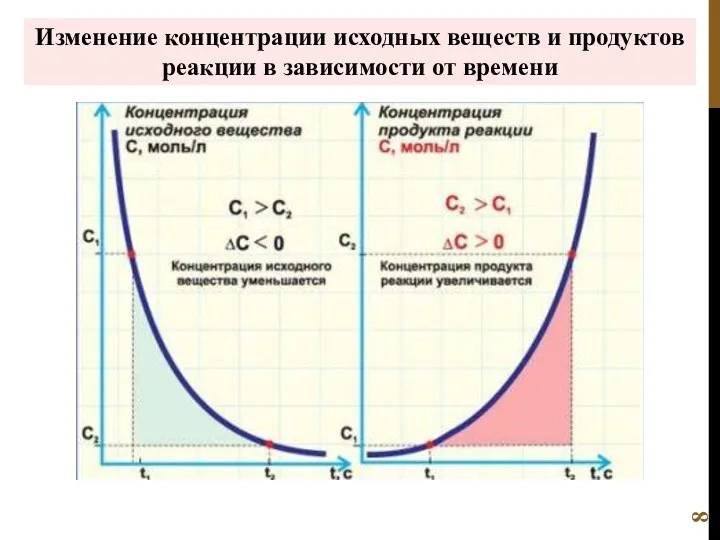
- 8. Изменение концентрации исходных веществ и продуктов реакции в зависимости от времени
- 9. Факторы, влияющие на скорость химических реакций: природа реагирующих веществ; концентрация реагирующих веществ; температура; катализатор; Для гетерогенных
- 10. Концентрация Температура Природа реагентов S поверхности соприкосновения
- 11. Закон действующих масс аА + bB = продукты где с(А) и с(В) – молярные концентрации реагирующих
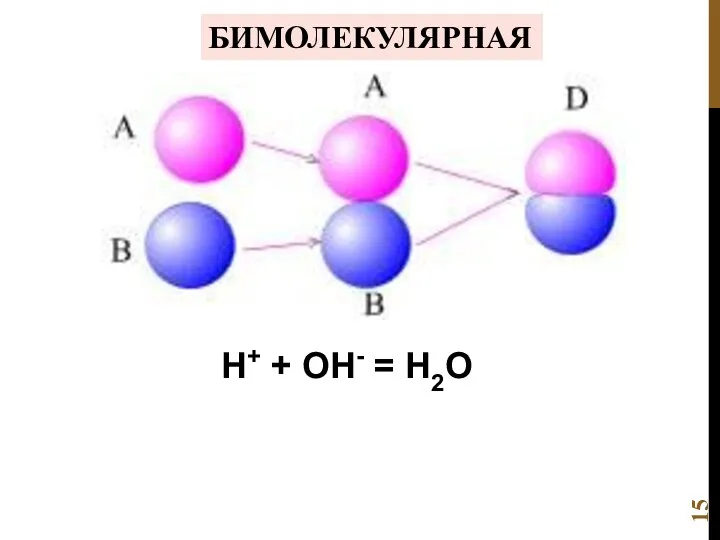
- 12. Н+ + ОН- = Н2О Для простых (элементарных) реакций показатели степени совпадает со стехиометрическими коэффициентами: Реакция
- 13. Порядок реакции для сложных реакций: 2 N2O5(г.) → 4 NO2(г.) + O2(г.) S (тв.) + O2
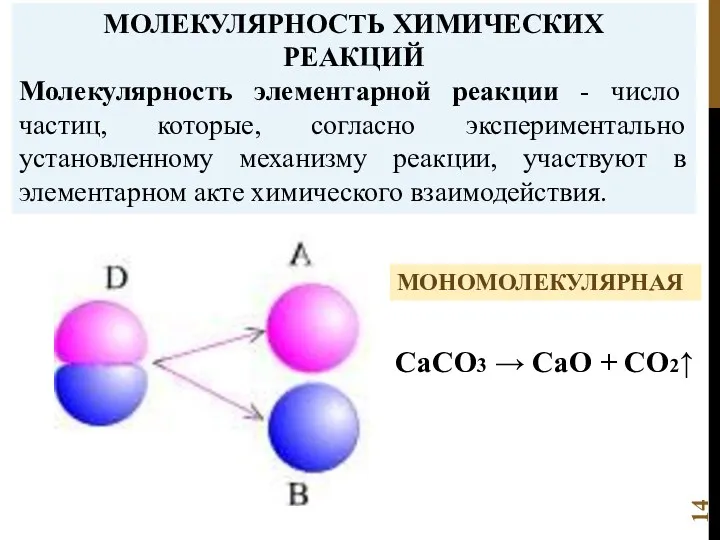
- 14. МОЛЕКУЛЯРНОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ Молекулярность элементарной реакции - число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют
- 15. БИМОЛЕКУЛЯРНАЯ Н+ + ОН- = Н2О
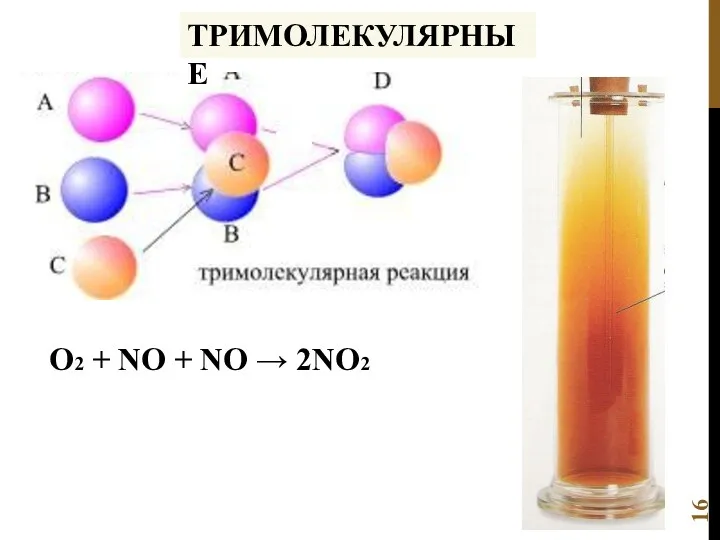
- 16. ТРИМОЛЕКУЛЯРНЫЕ О2 + NО + NО → 2NО2
- 17. Константа скорости реакции Где С – концентрация, через определенный промежуток времени τ.
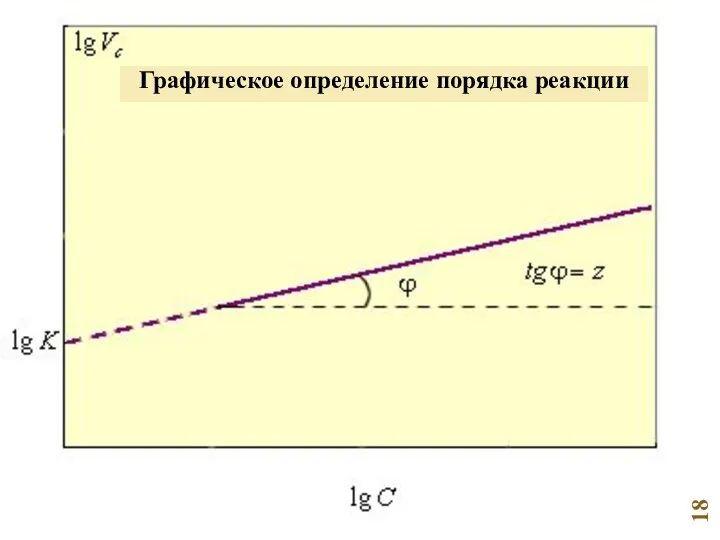
- 18. Графическое определение порядка реакции
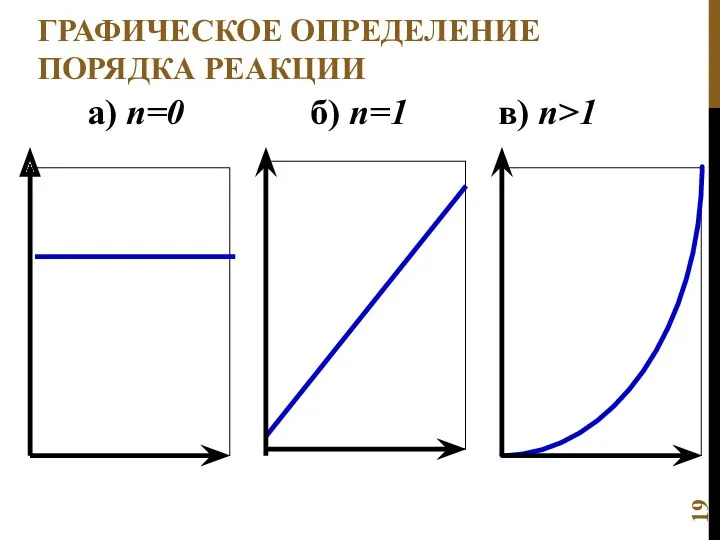
- 19. ГРАФИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПОРЯДКА РЕАКЦИИ а) n=0 б) n=1 в) n>1
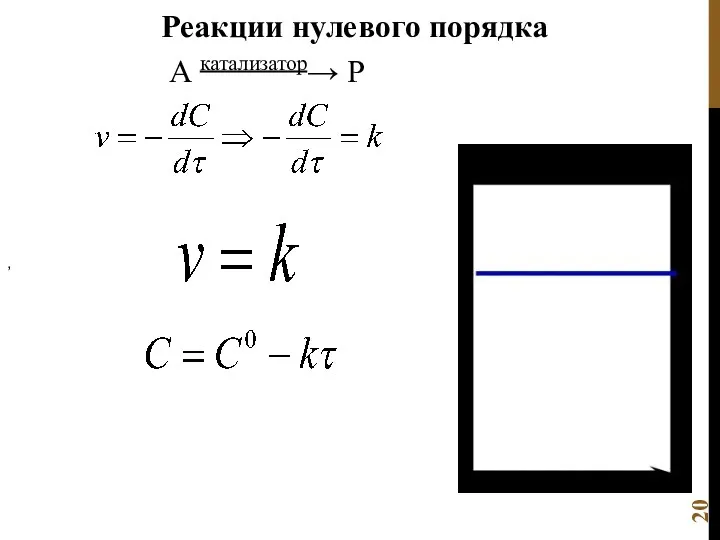
- 20. Реакции нулевого порядка А катализатор→ Р ,
- 21. Фотохимические реакции Каталитические реакции Ферментные процессы
- 22. Период полупревращения период полупревращения (τ1/2) – это такое время, за которое концентрация какого-либо из реагентов снижается
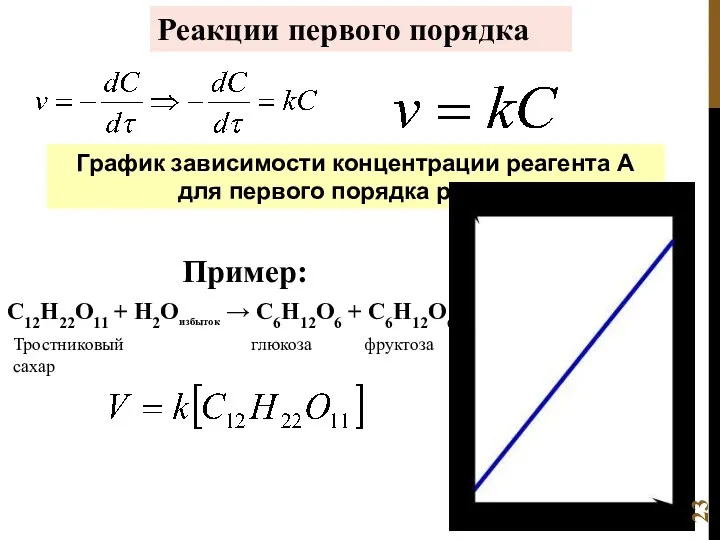
- 23. Реакции первого порядка График зависимости концентрации реагента A для первого порядка реакции Пример:
- 24. Период полупревращения для реакций первого порядка
- 25. Задача: За 20 минут из организма выводится половинное количество лекарства. Определите время выведения 90% препарата. Дано:
- 26. Решение: с ≈ 66 мин
- 27. Реакции второго порядка тогда, Для односубстратных реакций:
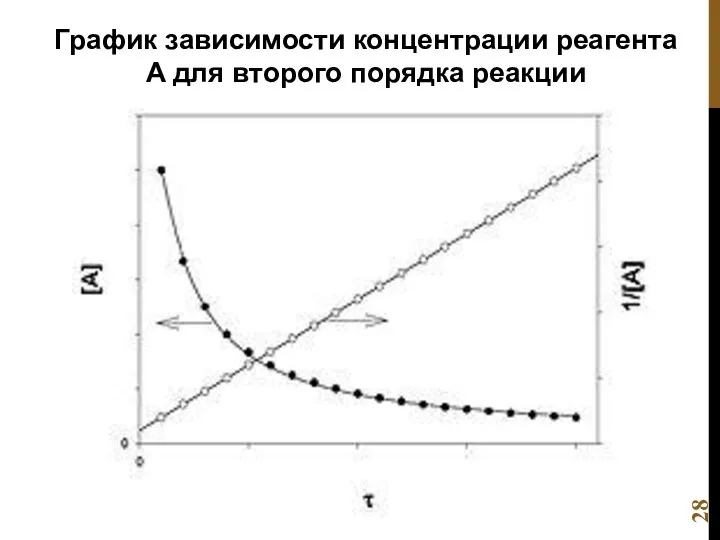
- 28. График зависимости концентрации реагента A для второго порядка реакции
- 29. ВЛИЯНИЕ ТЕМПЕРАТУРЫ - температурный коэффициент Вант-Гоффа, показывает во сколько раз возросла скорость химической реакции. Правило Вант-Гоффа
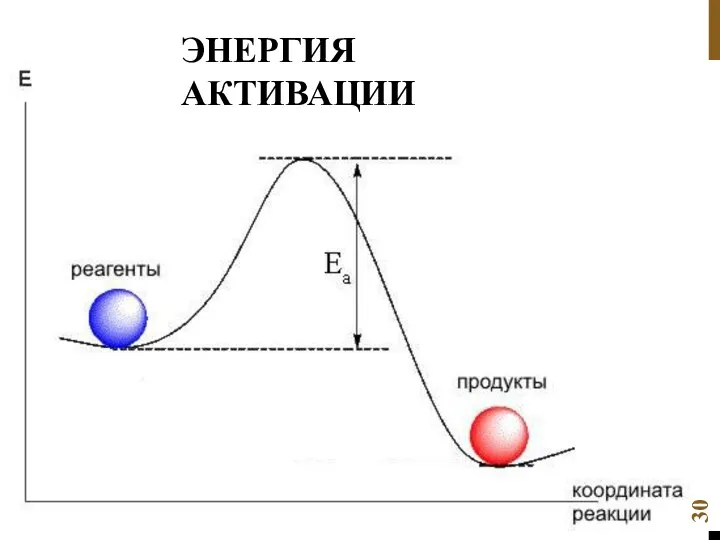
- 30. ЭНЕРГИЯ АКТИВАЦИИ
- 31. Уравнение Аррениуса А – постоянная величина, характеризует частоту столкновений; - энергия активации; R – газовая постоянная
- 32. Энергию активации можно найти по графику зависимости lgk от 1/Т или по уравнению:
- 33. Основные положения теории активных соударений: Реакционноспособными являются не все молекулы, а только те, которые находятся в
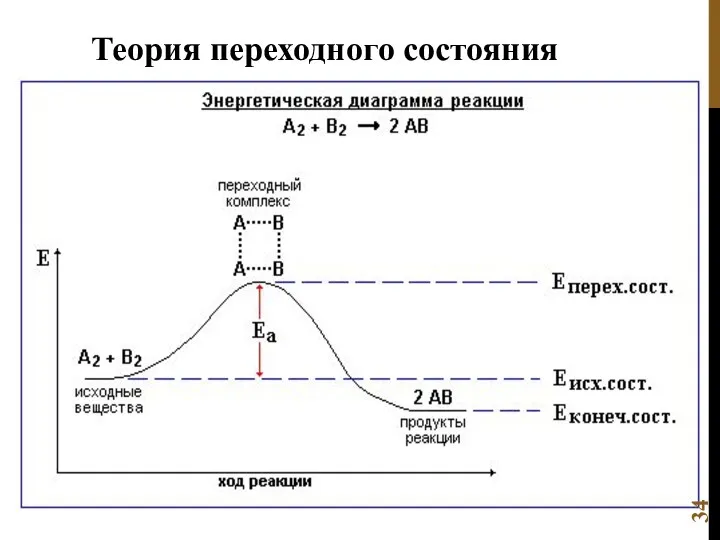
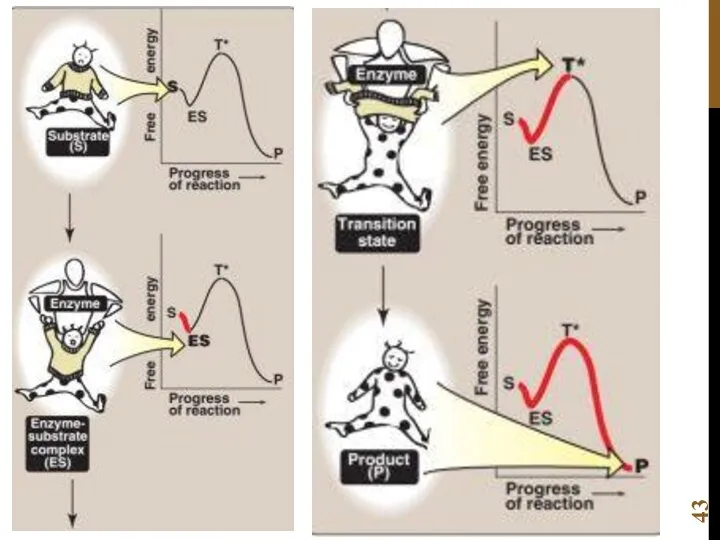
- 34. Теория переходного состояния
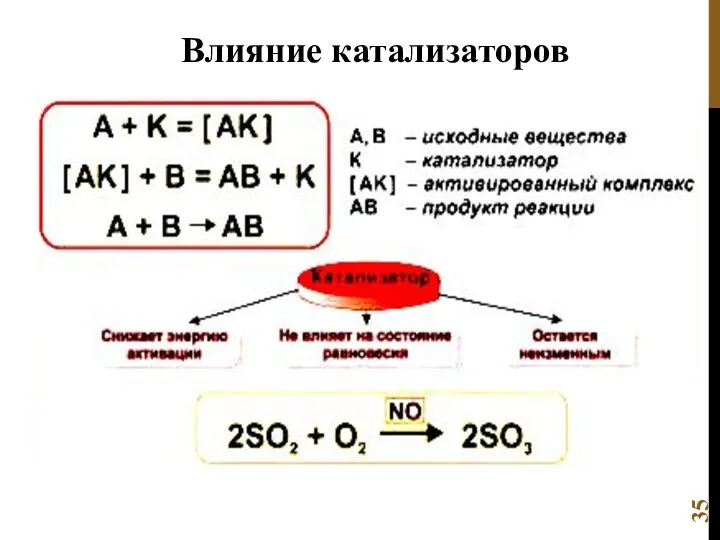
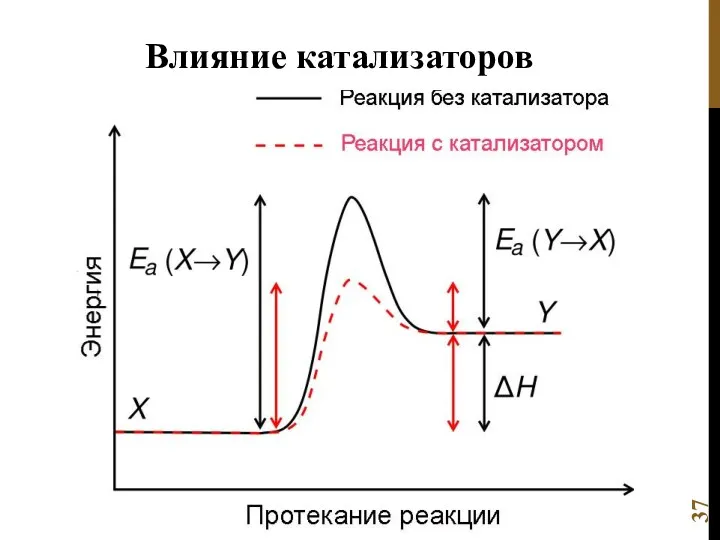
- 35. Влияние катализаторов
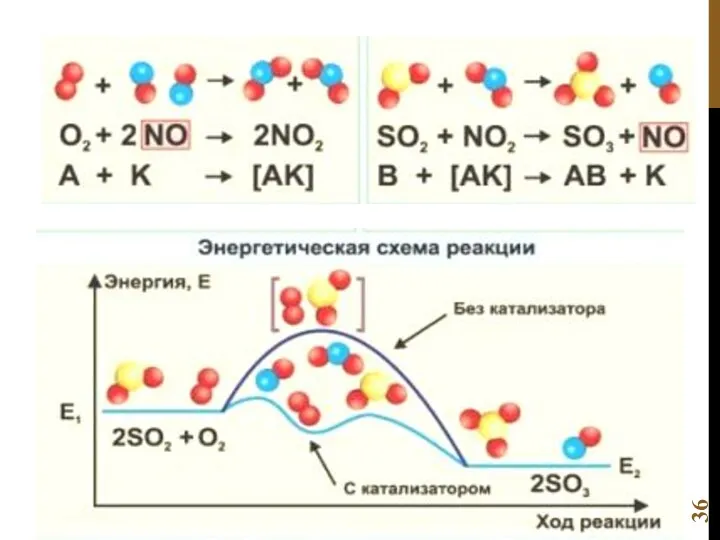
- 37. Влияние катализаторов
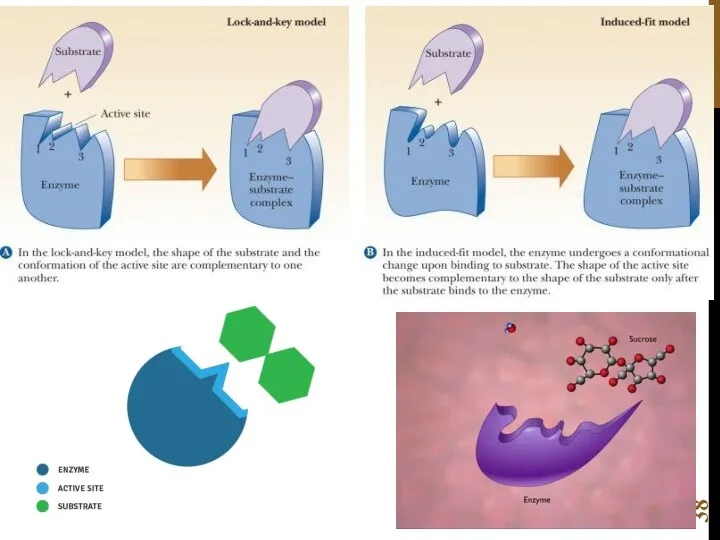
- 39. Мауд Леонора Ментен 1879 – 1960, Канада биохимик и физиолог Леонор Михаэлис 1875—1949 Берлин, Германия -
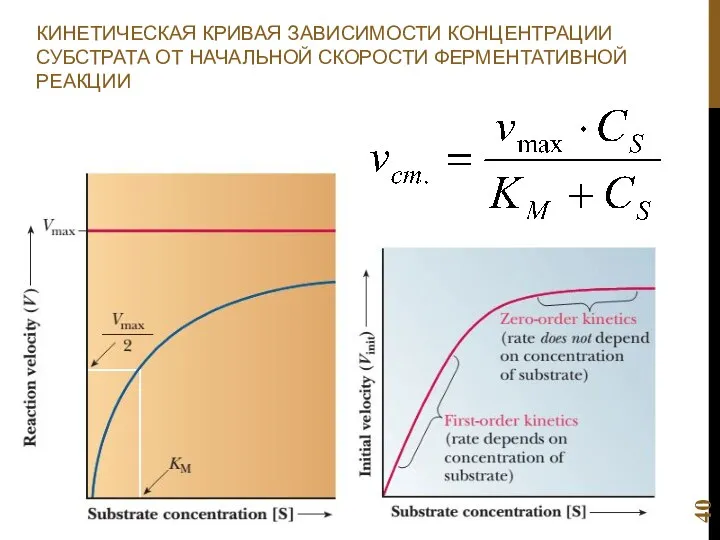
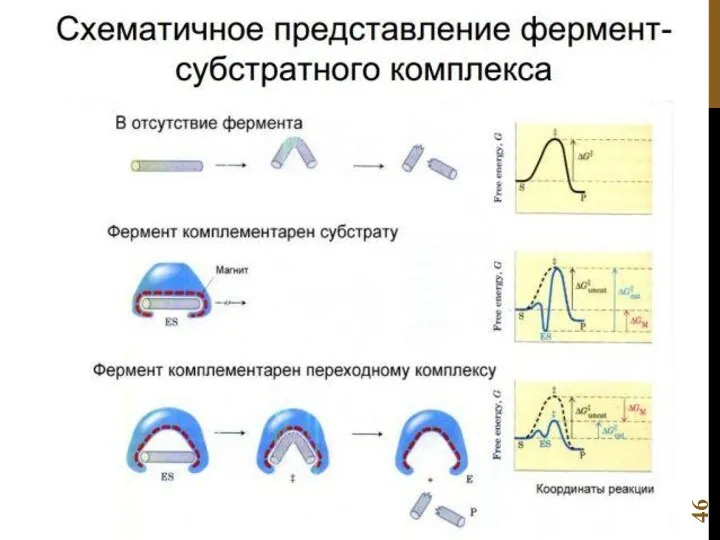
- 40. КИНЕТИЧЕСКАЯ КРИВАЯ ЗАВИСИМОСТИ КОНЦЕНТРАЦИИ СУБСТРАТА ОТ НАЧАЛЬНОЙ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
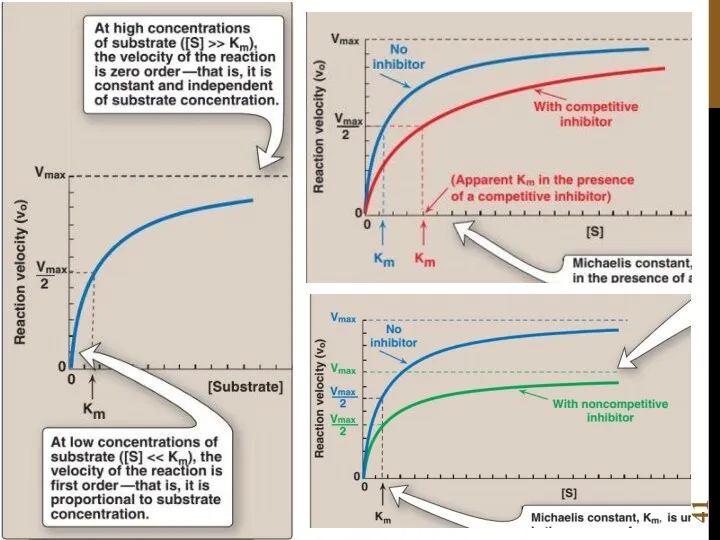
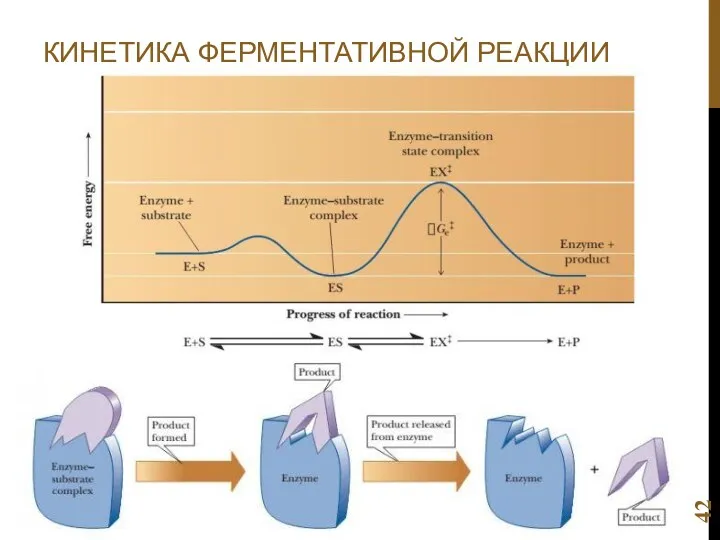
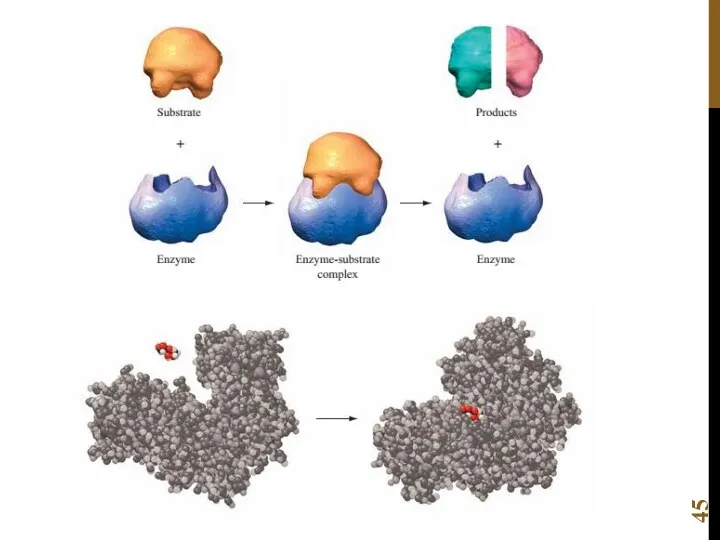
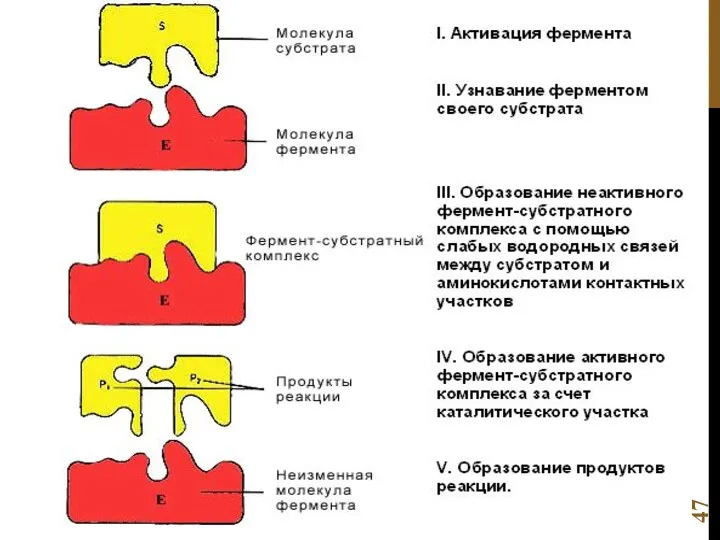
- 42. КИНЕТИКА ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
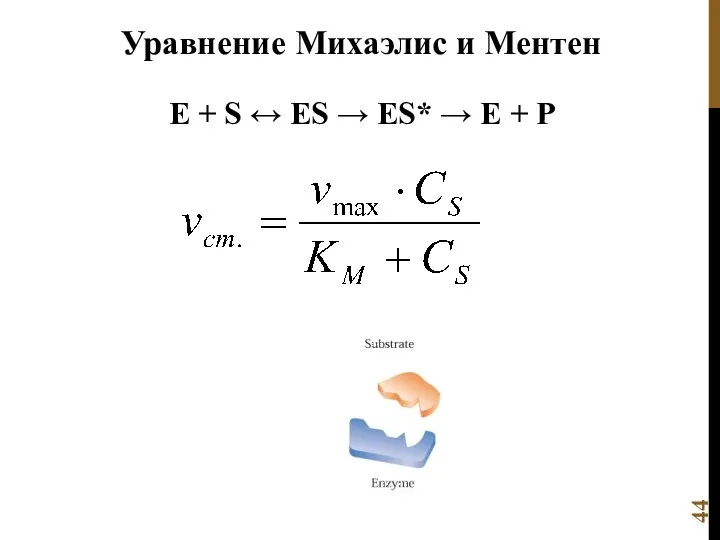
- 44. E + S ↔ ES → ES* → E + P Уравнение Михаэлис и Ментен
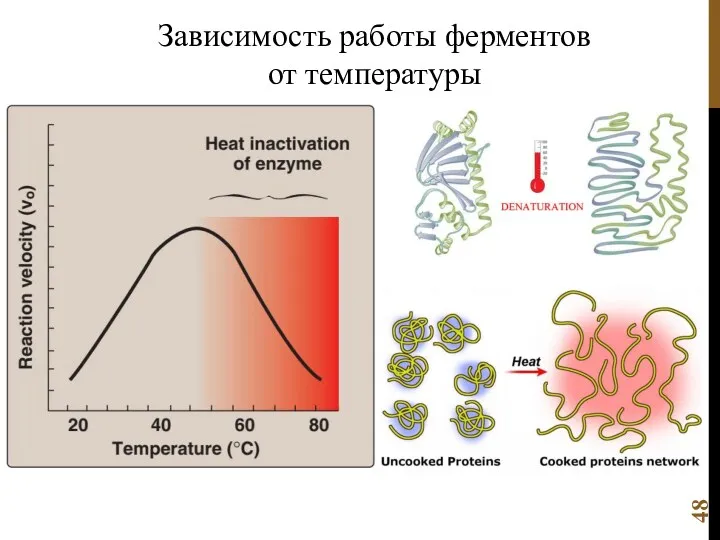
- 48. Зависимость работы ферментов от температуры
- 50. Скачать презентацию




















 Химические реакции
Химические реакции Геохимия окружающей среды и здоровье человека
Геохимия окружающей среды и здоровье человека Химическая связь
Химическая связь Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Electrochemistry
Electrochemistry Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Общая геохимия. Изотопы и их использование при решении геологических проблем
Общая геохимия. Изотопы и их использование при решении геологических проблем Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Чем опасны нитраты
Чем опасны нитраты Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем
Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Исследование снежного покрова
Исследование снежного покрова Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Строение атома
Строение атома Хімія в побуті
Хімія в побуті Химия в пище. Пищевые добавки
Химия в пище. Пищевые добавки Щелочные металлы
Щелочные металлы Типы химических реакций
Типы химических реакций Химический элемент гелий
Химический элемент гелий Азот. Фосфор
Азот. Фосфор Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Лекция 8. Электрохимия
Лекция 8. Электрохимия Основные классы неорганических веществ
Основные классы неорганических веществ Физические и химические свойства воды
Физические и химические свойства воды