Содержание
- 2. Что такое электрический ток ? Электрический ток это направленное движение заряженных частиц
- 3. Перечислите условия существования тока
- 4. Условия существования электрического тока Наличие свободных заряженных частиц Наличие электрического поля Замкнутая электрическая цепь
- 5. Какие превращения энергии происходят внутри источника тока ?
- 6. Источники тока - это устройства, которые преобразуют какой-либо вид энергии в электрическую энергию. К ним относятся:
- 8. Что такое окислительно-восстановительные реакции (ОВР)? (Это реакции, в процессе которых меняются степени окисления как минимум двух
- 9. Что такое окислительно-восстановительные реакции (ОВР)? Это реакции, в процессе которых меняются степени окисления как минимум двух
- 10. Электролиз – это совокупность окислительно-восстановительных процессов, протекающих на электродах (катоде и аноде), если через раствор или
- 11. При электролизе окислителем и восстановителем является электрический ток. Процессы окисления и восстановления разделены в пространстве, они
- 12. Электролиз расплавов ПРИМЕНЕНИЕ: Электролиз расплава солей или оксидов – для получения высокоактивных металлов (калия, алюминия и
- 15. Примеры электролиза расплавов NaCl K(-): Na ++ 1e → Na0 A(+): 2Cl- - 2e → Cl2
- 16. Электролиз растворов процесс более энергетически выгодный, чем электролиз расплавов при электролизе как на аноде, так и
- 17. Если металл стоит до Н, то вместо него электролизу подвергается вода: 2H2O + 2е = H2
- 19. Ряд напряжений металлов Li K Rb Ba Ca Na Mg Al| Mn Zn Cr Fe Cd
- 20. ЭЛЕКТРОЛИЗ РАСТВОРА ХЛОРИДА НАТРИЯ
- 21. Теперь анионы-кислотные остатки: Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода: 2H2O — 4e =
- 22. Cu(NO3)2, HOH Cu+2 Катод (– ) Анод (+) OH-1 NO3-1 Н +1 На катоде: Cu+2 +2e
- 23. При электролизе раствора нитрата серебра масса катода увеличилась на 6 г. Вычислите объем газа выделившегося на
- 24. При электролизе раствора нитрата серебра масса катода увеличилась на 6 г. Вычислите объем газа выделившегося на
- 25. Задача (продолжение) Сократим Н2О в обоих частях уравнения: 4AgNO3 + 2Н2О 4Ag0 + О20 + 4HNO3
- 28. Скачать презентацию
 Полимерные материалы
Полимерные материалы Целлюлоза
Целлюлоза Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Органическая химия. Лекция - Оксокислоты
Органическая химия. Лекция - Оксокислоты Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Предмет органической химии
Предмет органической химии Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Нитросоединения
Нитросоединения Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Электродные процессы
Электродные процессы Гетероциклды қосылыстар. Алкалоидтар
Гетероциклды қосылыстар. Алкалоидтар General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Изомеризация пентан-гексановой фракции
Изомеризация пентан-гексановой фракции Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Каучук
Каучук Основные разделы химии
Основные разделы химии Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар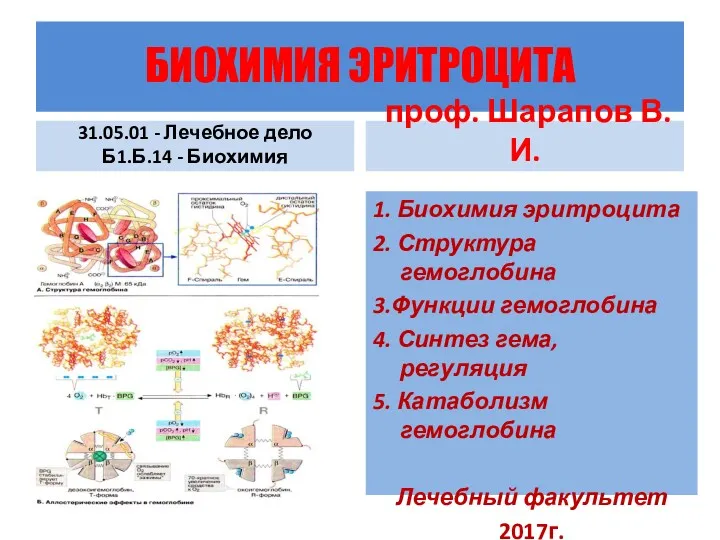 Биохимия эритроцита
Биохимия эритроцита Відносна молекулярна маса
Відносна молекулярна маса Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Минералы. Свойства минералов
Минералы. Свойства минералов Начала химической термодинамики
Начала химической термодинамики Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Электролитическая диссоциация. Сущность электролитической диссоциации
Электролитическая диссоциация. Сущность электролитической диссоциации Разнообразие неметаллов
Разнообразие неметаллов