Содержание
- 2. Caracteristica generală, proprietăți fizice și chimice ale substanțelor pe clase: 1.Acizi; 2. Baze; 3.Oxizi; 4.Săruri. Chestionar
- 3. Identificarea proprietăților fizice și chimice ale acizilor, bazelor, oxizilor și sărurilor; Caracterizarea tipurilor de reacții chimice
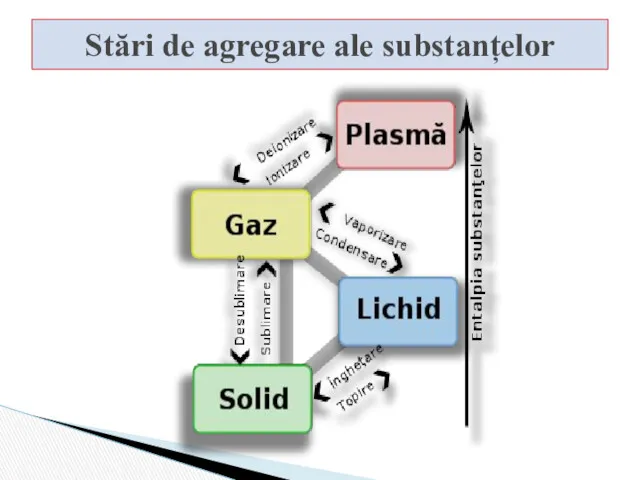
- 4. Stări de agregare ale substanțelor
- 5. Proprietăţi generale Acizii au gust acru, sunt caustici(ard); înroşesc turnesolul, respectiv metiloranjul; descompun piatra de var
- 6. CLASIFICAREA ACIZILOR ȘI BAZELOR Acizii: - compoziţia lor (hidracizi, conțin H și nemetal: HCl, HBr, HI)
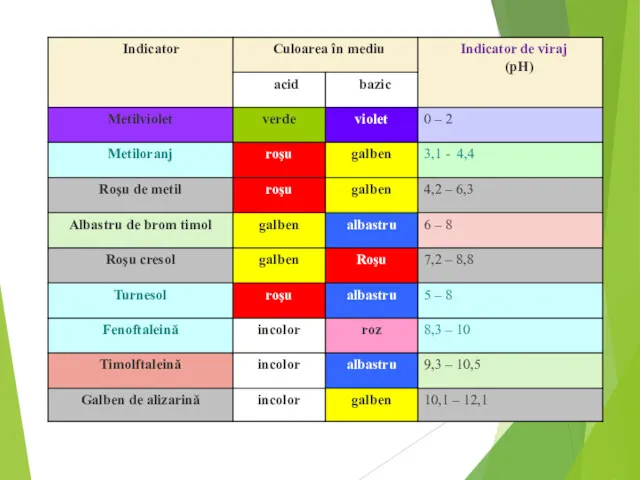
- 7. Indicatorii acido – bazici sunt substanţe organice care îşi schimbă structura şi în consecinţă, culoarea, în
- 9. PROPRIETATILE FIZICE ALE ACIZILOR Acizii sunt substante - gazoase: HCl, H2S - lichide: HNO3, H2SO4 -
- 10. PROPRIETATILE CHIMICE ALE ACIZILOR Acțiunea asupra indicatorilor Soluția de turnesol – roșie Soluția de fenolftaleină- incoloră
- 11. Reactia acizilor cu oxizii bazici=sare+H2O 2HCl+CaO CaCl2+H2O H2SO4+CuO CuSO4+H2O Reactia de neutralizare = sare +H2O HCl
- 12. IMPORTANTA SI UTILIZARILE ACIZILOR Acizii se folosesc în laborator – reactivi : obținerea sărurilor, H2, neutralizarea
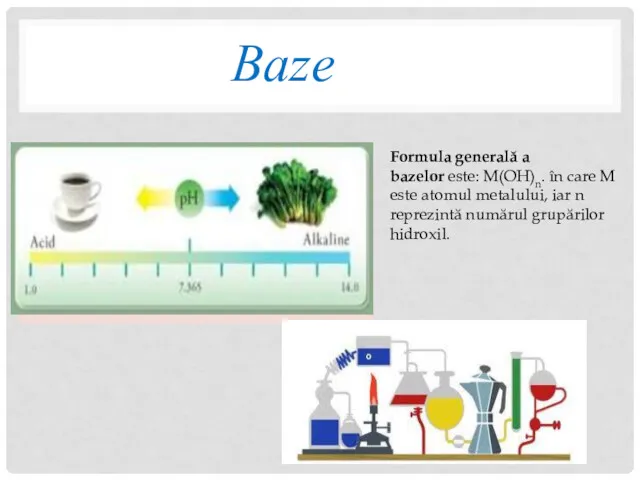
- 13. Baze Formula generală a bazelor este: M(OH)n. în care M este atomul metalului, iar n reprezintă
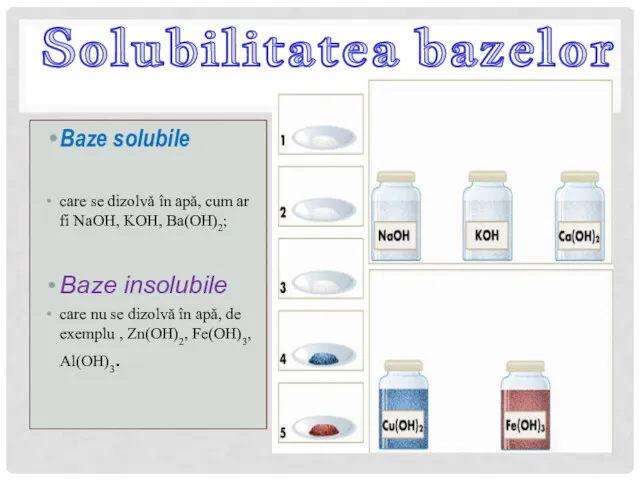
- 14. Baze solubile care se dizolvă în apă, cum ar fi NaOH, KOH, Ba(OH)2; Baze insolubile care
- 15. PROPRIETĂȚI FIZICE • hidroxizii alcalini sunt substanţe solide, albe, opace, higroscopice, bine solubile în apă. •
- 16. PROPRIETĂȚI CHIMICE Unii hidroxizi (de Zn, Al, Sn, Pb) au caracter amfoter , adica reactioneaza cu
- 17. Reactia de neutralizare Toate bazele reactioneaza cu acizii, formand saruri si apa. NaOH + HCl =
- 18. OXIZII Oxizii - sunt compuşi binari ai oxigenului cu alte elemente, metale sau nemetale. Se cunosc
- 19. Proprietăţi fizice la temperatura obişnuită, majoritatea oxizilor sunt substanţe solide sau gazoase; • oxizii metalelor pot
- 20. METODE DE OBTINERE Reacţii de combinare a)Reacţia metalelor cu oxigenul 4Na + O2 => 2Na2O b)Reacţia
- 21. REACŢII DE DESCOMPUNERE CaCO3 ? CaO + CO2 MgCO3 ? MgO + CO2 CuCO3 ? CuO
- 22. PROPRIETĂȚI CHIMICE A)Reacţii cu substanţe simple: Oxizii superiori pot fi obţinuţi prin reacţia oxizilor inferiori cu
- 23. REACŢII CU SUBSTANŢE COMPUSE a)Reacţionează cu apa oxid metalic + apa => baza CaO + H2O
- 24. REACŢIA BAZELOR CU OXIZI ACIZI oxid acid+ bază => sare + apă CO2 + Ca(OH)2 =>CaCO3+
- 25. IMPORTANŢĂ ŞI UTILIZĂRI: materii prime: Al2O3 (bauxita), FeO, Fe2O3; materiale de construcţii: CaO, SiO2; obţinerea acizilor:
- 26. CARACTERISTICILE UNOR OXIZI CO Nu întreține arderea, dar arde cu flacară albastră si formează CO2.Este gaz
- 27. SĂRURILE Sărurile sunt combinaţii cu structură ionică, în general, formate prin neutralizarea unui acid cu o
- 28. Săruri normale (neutre) NaCl — clorură de sodiu CaCO3 — carbonat de calciu CuSO4 —sulfat de
- 29. proprietăți chimice Reactia sarurilor cu metalele CuSO4+Fe Cu +FeSO4 AgNO3+Cu Ag + Cu(OH)3 2. Reactia sarurilor
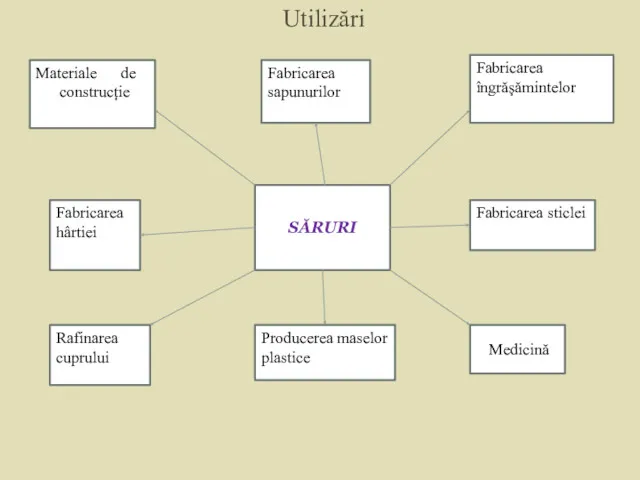
- 30. Utilizări Materiale de construcție Fabricarea hârtiei Rafinarea cuprului Fabricarea sapunurilor Fabricarea îngrășămintelor Fabricarea sticlei SĂRURI Producerea
- 32. Скачать презентацию
























 Лекция № 5. Спектральный анализ непериодических сигналов
Лекция № 5. Спектральный анализ непериодических сигналов Динамика кулисного механизма
Динамика кулисного механизма Жарық көздері Бірінші ретті жарық көздері
Жарық көздері Бірінші ретті жарық көздері Погрешности измерений
Погрешности измерений Термоэлектрические явления и их применение
Термоэлектрические явления и их применение Кипение и конденсация
Кипение и конденсация Расчетный напор НС-2 при расположении башни в начале сети
Расчетный напор НС-2 при расположении башни в начале сети Основное уравнение молекулярно-кинетической теории газов
Основное уравнение молекулярно-кинетической теории газов Интерференция света
Интерференция света Процедура разборки КПП Wet 8DCT (D8LF1)
Процедура разборки КПП Wet 8DCT (D8LF1) Инерция 7 класс Сила инерции
Инерция 7 класс Сила инерции Автоматические трансмиссии
Автоматические трансмиссии The horizon line
The horizon line Движение и взаимодействие тел
Движение и взаимодействие тел Напружений і деформований стани твердих тіл
Напружений і деформований стани твердих тіл Химические источники тока
Химические источники тока Бойове застосування КЗА 86Ж6. Система електроживлення. Апаратура радіаційної та хімічної розвідки. (Тема 9.5)
Бойове застосування КЗА 86Ж6. Система електроживлення. Апаратура радіаційної та хімічної розвідки. (Тема 9.5) В мире оптических иллюзий
В мире оптических иллюзий Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы
Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы Источники света. Распространение света. Отражение света. 8 класс
Источники света. Распространение света. Отражение света. 8 класс Исследовательская работа Посудомоечная машина
Исследовательская работа Посудомоечная машина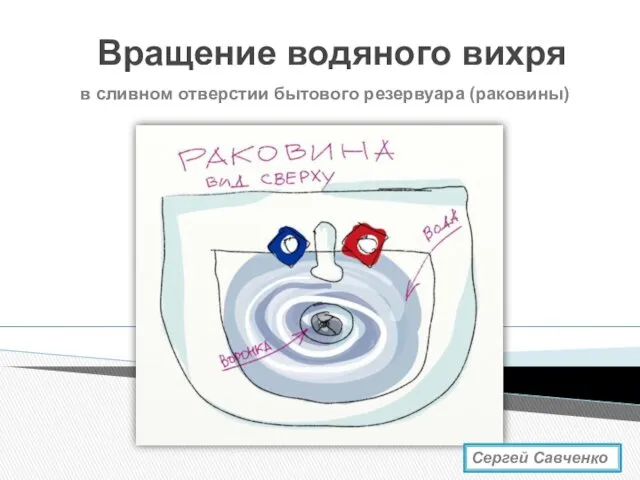 Водяная воронка. Вращение водяного вихря
Водяная воронка. Вращение водяного вихря Масса, плотность, объем. 7 класс
Масса, плотность, объем. 7 класс Физический десант
Физический десант Кулачковые механизмы
Кулачковые механизмы тест по физике 7 класс
тест по физике 7 класс Ускорители заряженных частиц. Магнитное поле
Ускорители заряженных частиц. Магнитное поле Основные положения МКТ и их опытные обоснования
Основные положения МКТ и их опытные обоснования