Содержание
- 2. СН2=СН2 + СО + Н2О→ СН3СН2СООН Карбонилирование спиртов Карбонилирование алкенов СН3ОН + СО → СН3СООН CH3CH=CH2
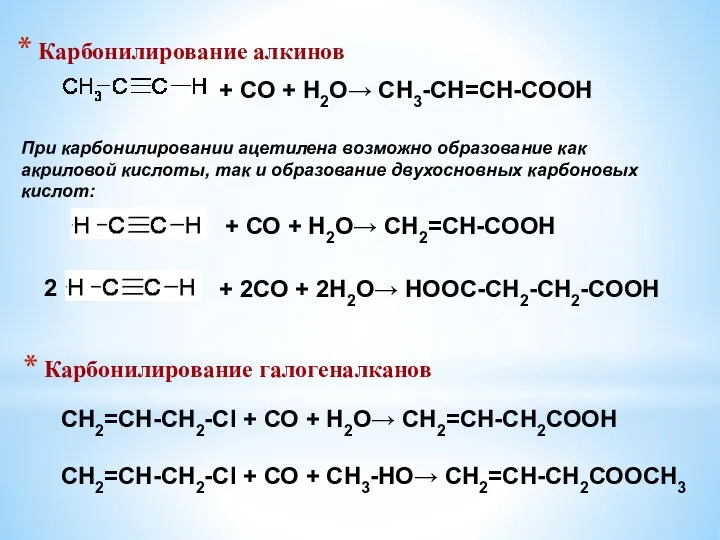
- 3. Карбонилирование алкинов + СО + Н2О→ СН3-СН=СН-СООН При карбонилировании ацетилена возможно образование как акриловой кислоты, так
- 4. IV. Химические свойства Химические свойства карбоновых кислот определяются особенностями строения карбоксильной группы и строением связанного с
- 5. В группе С = О атом углерода несет частичный положительный заряд и притягивает к себе неподеленную
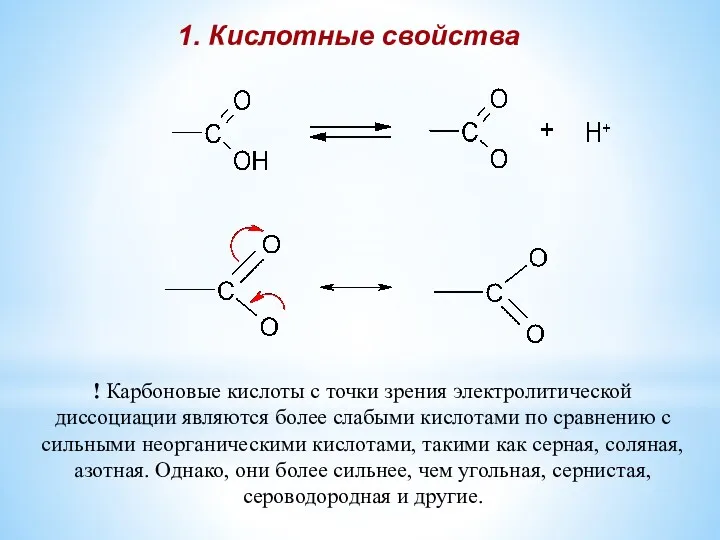
- 6. 1. Кислотные свойства ! Карбоновые кислоты с точки зрения электролитической диссоциации являются более слабыми кислотами по
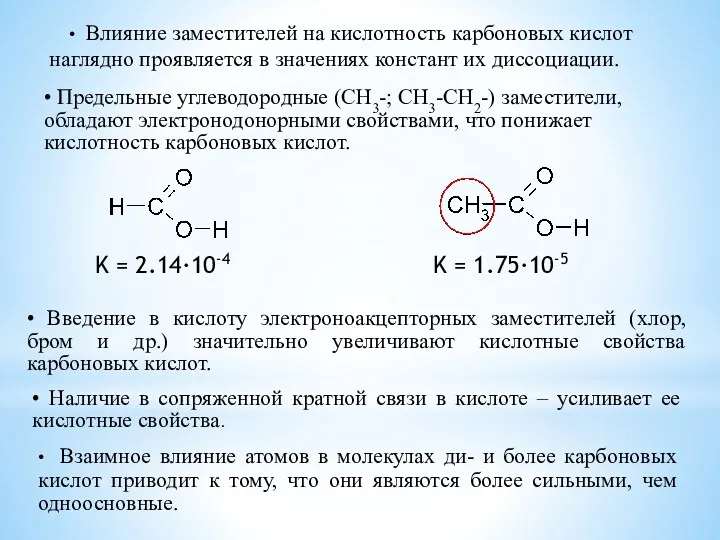
- 7. K = 2.14·10-4 K = 1.75·10-5 • Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в
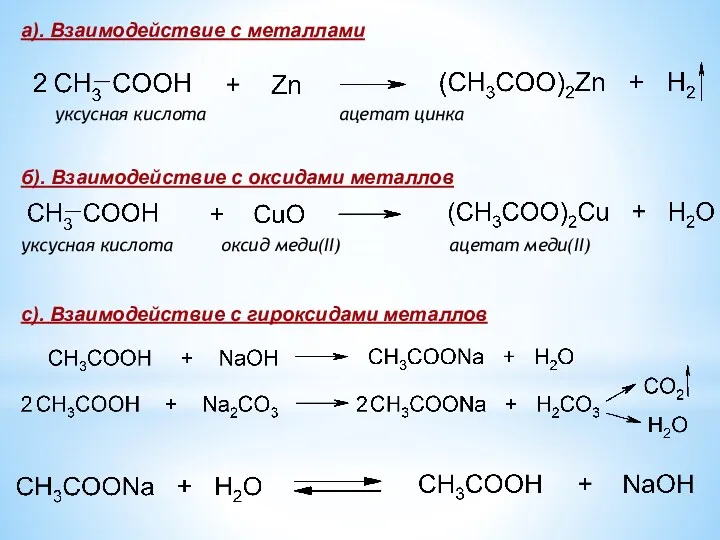
- 8. уксусная кислота ацетат цинка уксусная кислота оксид меди(II) ацетат меди(II) а). Взаимодействие с металлами б). Взаимодействие
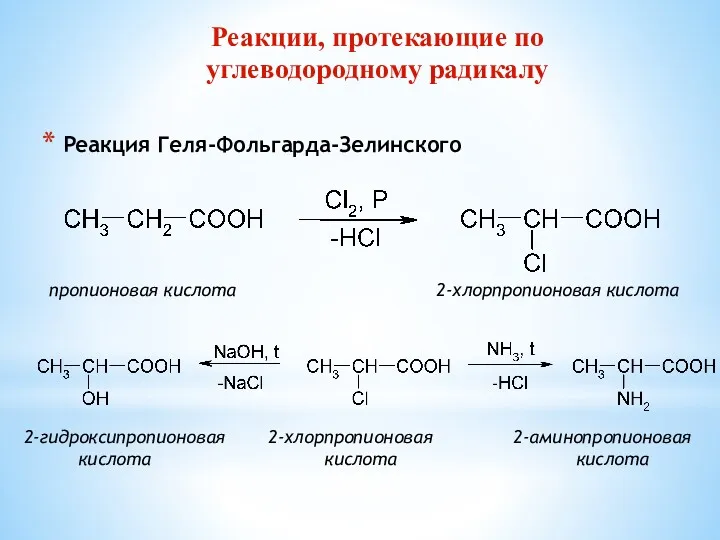
- 9. Реакции, протекающие по углеводородному радикалу Реакция Геля-Фольгарда-Зелинского пропионовая кислота 2-хлорпропионовая кислота 2-гидроксипропионовая 2-хлорпропионовая 2-аминопропионовая кислота кислота
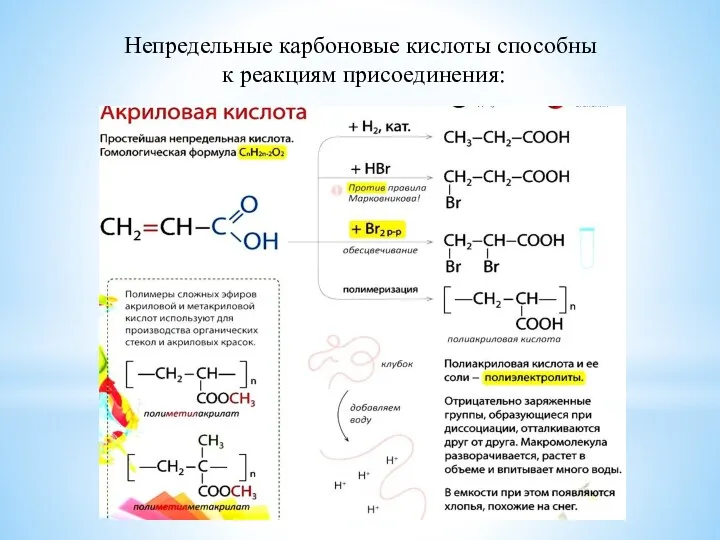
- 10. Непредельные карбоновые кислоты способны к реакциям присоединения:
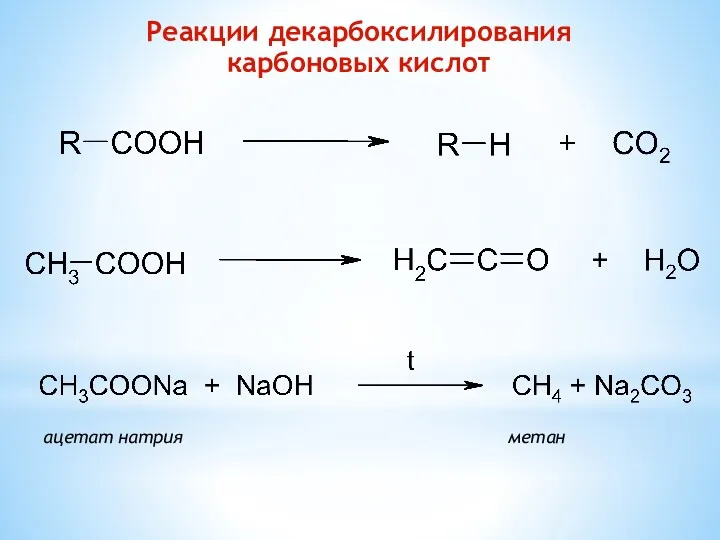
- 11. Реакции декарбоксилирования карбоновых кислот ацетат натрия метан
- 12. Двухосновные карбоновые кислоты при нагревании отщепляют С02: НООС-СООН → НСООН + СО2, НООС-СН2-СООН → СН3-СООН +
- 13. Если при декарбоксилировании происходит ещё и окисление кислоты, то такое декарбоксилирование называется окислительным. Реакция Бородина-Хунсдиккера Реакция
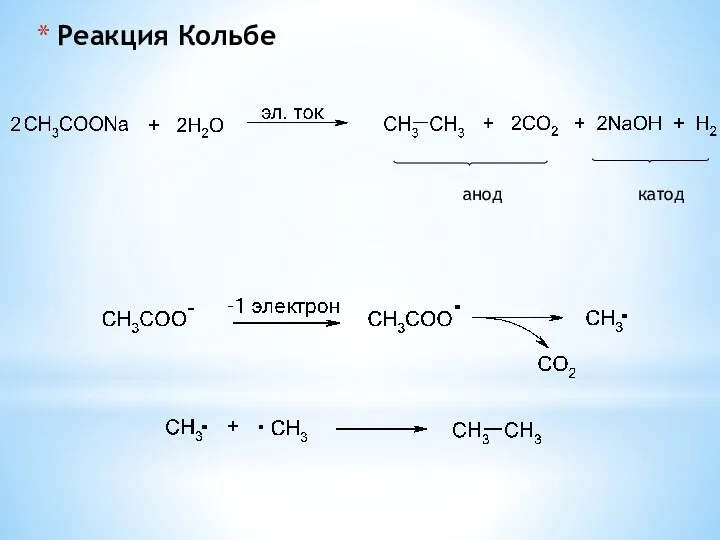
- 14. Реакция Кольбе анод катод
- 15. Окисление и восстановление карбоновых кислот Все карбоновые кислоты горят с образованием углекислого газа и воды (например,
- 17. Скачать презентацию






 Электрохимические процессы
Электрохимические процессы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Получение пресной и чистой воды
Получение пресной и чистой воды Валентные состояния атома углерода
Валентные состояния атома углерода Сероводород. Сульфиды
Сероводород. Сульфиды Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Biomass Feedstocks
Biomass Feedstocks Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Алюминий и его соединения
Алюминий и его соединения 20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva
20230306_znachenie_periodicheskogo_zakona_d._i._mendeleeva Кислотно-основные равновесия. Введение в титриметрию
Кислотно-основные равновесия. Введение в титриметрию Щелочные металлы
Щелочные металлы Застосування алканів
Застосування алканів Сера и ее свойства
Сера и ее свойства Магматические горные породы
Магматические горные породы Инертные газы
Инертные газы Периодический закон Менделеева
Периодический закон Менделеева Озон. Строние молекулы озона
Озон. Строние молекулы озона Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Закон сохранения массы веществ
Закон сохранения массы веществ Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Кислотно-основное титрование
Кислотно-основное титрование Волшебница - вода
Волшебница - вода Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе
Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе Оксиды неметаллов
Оксиды неметаллов Основания
Основания