Содержание
- 2. Историческая справка Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для
- 3. Историческая справка. Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого
- 4. Положение в ПСХЭ.
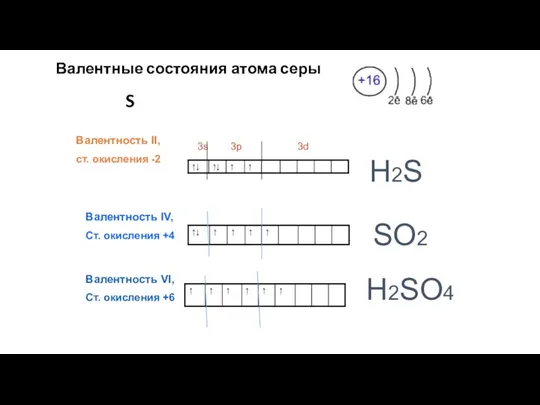
- 5. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
- 6. Нахождение серы в природе Самородная сера Сульфатная сера Сульфидная сера Ромбическая сера S8 Сероводород H2S, киноварь
- 8. Ромбическая сера Ромбическая (α-сера) - S8, желтого цвета, t°пл. = 113°C; Наиболее устойчивая модификация.
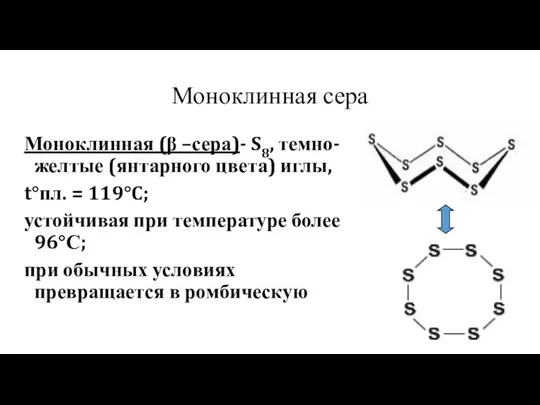
- 9. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые (янтарного цвета) иглы, t°пл. = 119°C; устойчивая при температуре
- 10. Пластическая сера Пластическая сера- темно-коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 11. Химические свойства Сера по сравнению с кислородом малоактивна. 1. Сера, как окислитель, легко соединяется с металлами
- 12. Химические свойства 2. Взаимодействие с неметаллами. Образует соединения почти со всеми неметаллами, но не так легко
- 13. Химические свойства 3. Взаимодействие со сложными веществами. При нагревании сера взаимодействует с кислотами- окислителями: S +
- 15. Скачать презентацию









 АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций Воздух и его состав
Воздух и его состав большая стирка
большая стирка Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией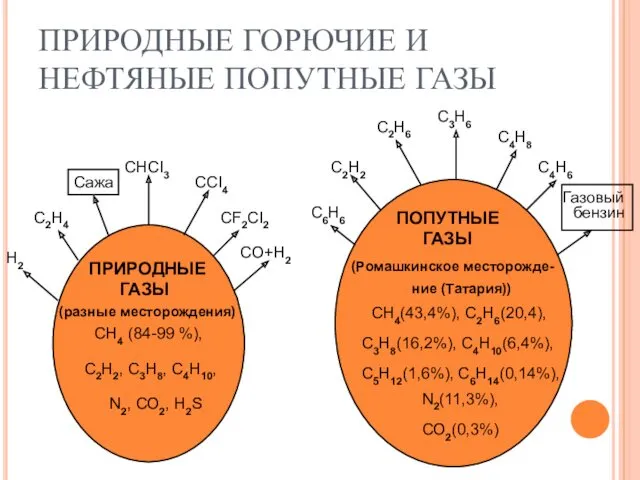 ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ
ПРИРОДНЫЕ ГОРЮЧИЕ И НЕФТЯНЫЕ ПОПУТНЫЕ ГАЗЫ Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Азотсодержащие органические соединения. Амины (часть 1)
Азотсодержащие органические соединения. Амины (часть 1) Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Соли. Определение солей
Соли. Определение солей Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени
Практическая работа №1. Приёмы безопасной работы с оборудованием и веществами. Строение пламени Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Алканы (предельные углеводороды)
Алканы (предельные углеводороды) Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Виведення формул органічних сполук за масовими частками елементів
Виведення формул органічних сполук за масовими частками елементів Химическая очистка воды
Химическая очистка воды Водород. Получение и свойства водорода
Водород. Получение и свойства водорода 530f2c0b0bb94f3085ed9ef5fc682ddb
530f2c0b0bb94f3085ed9ef5fc682ddb О каком веществе речь?
О каком веществе речь? 20231009_zhyostkost_vody
20231009_zhyostkost_vody Қаныққан бір атомды спитртер
Қаныққан бір атомды спитртер Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Производство серы из природного газа и продукты на ее основе
Производство серы из природного газа и продукты на ее основе Германій. Олово. Свинець
Германій. Олово. Свинець Poly (ethene). Polyethylene
Poly (ethene). Polyethylene Медь и сплавы на ее основе
Медь и сплавы на ее основе Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики