Содержание
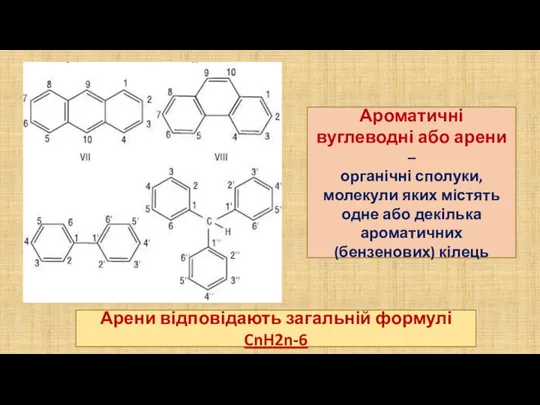
- 2. Ароматичні вуглеводні або арени – органічні сполуки, молекули яких містять одне або декілька ароматичних (бензенових) кілець
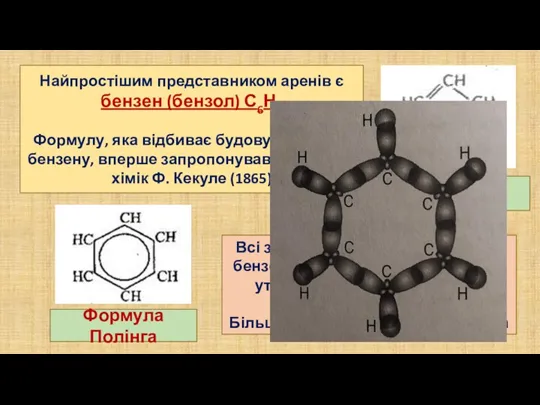
- 3. Найпростішим представником аренів є бензен (бензол) С6Н6 Формулу, яка відбиває будову молекули бензену, вперше запропонував німецький
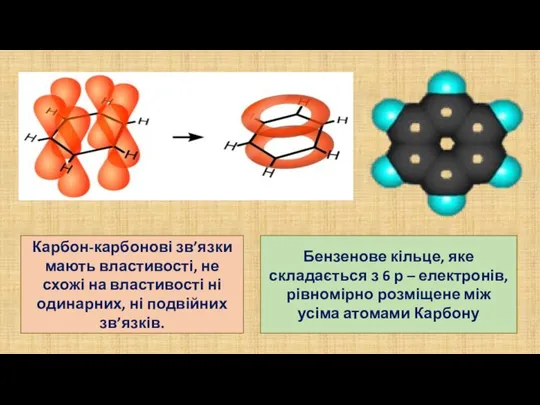
- 4. Бензенове кільце, яке складається з 6 р – електронів, рівномірно розміщене між усіма атомами Карбону Карбон-карбонові
- 5. Фізичні властивості бензену За стандартних умов бензен: безбарвна рідина з характерним запахом; у воді не розчиняється;
- 6. Хімічні властивості бензену Реакції заміщення (подібно до алканів) Бензенове кільце зберігається Реакції приєднання (подібно до алкенів)
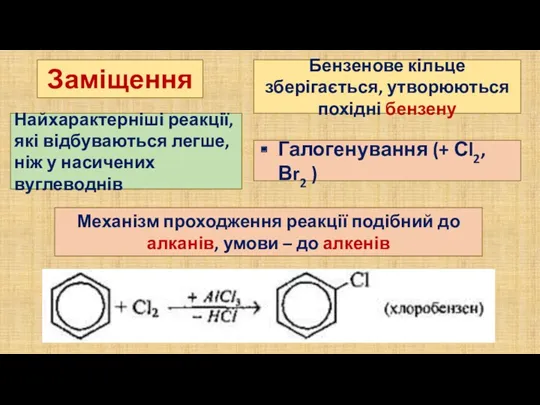
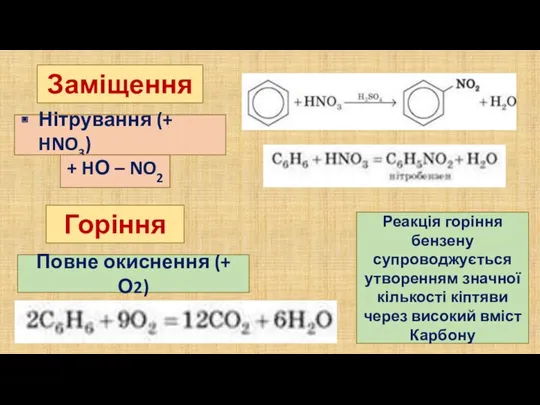
- 7. Заміщення Бензенове кільце зберігається, утворюються похідні бензену Найхарактерніші реакції, які відбуваються легше, ніж у насичених вуглеводнів
- 8. Повне окиснення (+ О2) Заміщення Горіння Нітрування (+ HNO3) + HО – NO2 Реакція горіння бензену
- 9. Приєднання Гідрування (+ Н2) Бензенове ядро є стійкішим, ніж звичайний π-зв’язок. Тому реакції приєднання менш характерні,
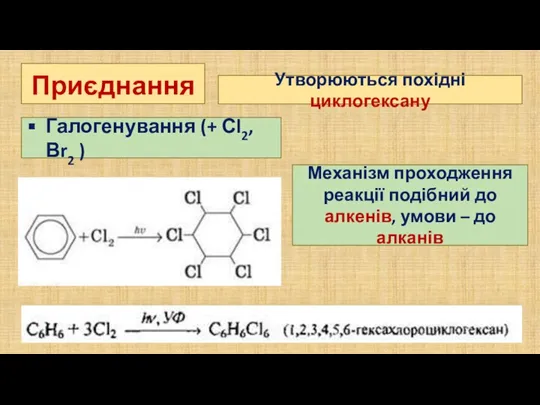
- 10. Приєднання Галогенування (+ Сl2, Вr2 ) Утворюються похідні циклогексану Механізм проходження реакції подібний до алкенів, умови
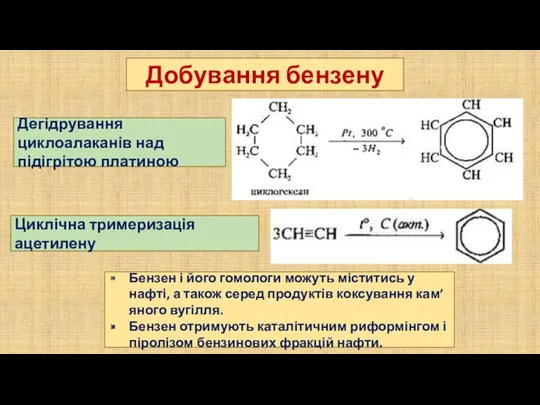
- 11. Дегідрування циклоалаканів над підігрітою платиною Циклічна тримеризація ацетилену Добування бензену Бензен і його гомологи можуть міститись
- 12. Застосування бензену • етилбензену (компонента високооктанових бензинів, вихідної речовини у виробництві старену, каучуків); • кумолу (проміжного
- 13. Здійснити перетворення Задача Який об'єм водню прореагував з бензеном масою 7, 8 г? Яка маса продукту
- 15. Скачать презентацию





 Особенности строения твердых тел
Особенности строения твердых тел Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Вводная лекция
Вводная лекция Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение)
Дробный метод анализа металлических ядов в минерализате (деструктате) (Продолжение) Химия в строительстве
Химия в строительстве Этот многоликий цинк
Этот многоликий цинк Хроматографические методы анализа
Хроматографические методы анализа Химическая связь
Химическая связь Кинетика химических реакций и химическое равновесие
Кинетика химических реакций и химическое равновесие Соединения серы
Соединения серы Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Кислоты. Индикаторы
Кислоты. Индикаторы Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Изомерия
Изомерия Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Облучение. Радиационная окраска
Облучение. Радиационная окраска Хром. Строение атома
Хром. Строение атома Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Алкены
Алкены Оксиды. Физические свойства
Оксиды. Физические свойства Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Химия. D-элементтер
Химия. D-элементтер Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Полимеры, бумага
Полимеры, бумага 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva