Содержание
- 2. 7.1. Нейтрализация
- 3. Нейтрализация Химическая реакция между веществом, обладающим свойствами кислоты, и веществом, обладающим свойствами основания, в результате которой
- 4. Основные способы нейтрализации Взаимная нейтрализация кислых и щелочных вод смешением; Нейтрализация реагентами; Нейтрализация фильтрованием через нейтрализующие
- 5. 7.1.1. Нейтрализация смешением кислых и щелочных вод
- 6. Условия применения способа Наличие одновременно кислых и щелочных вод; Установка усреднителей – накопителей, обеспечивающих равномерное отведение
- 7. 7.1.2. Нейтрализация вод реагентами
- 8. Условия применения способа При наличии только кислых или щелочных вод. Основные реагенты Растворы кислот; Негашеная известь
- 9. Факторы, учитываемые при выборе реагента Вид кислот; Концентрация кислот; Режим поступления вод; Растворимость продуктов реакции нейтрализации.
- 10. Расчетное количество реагента
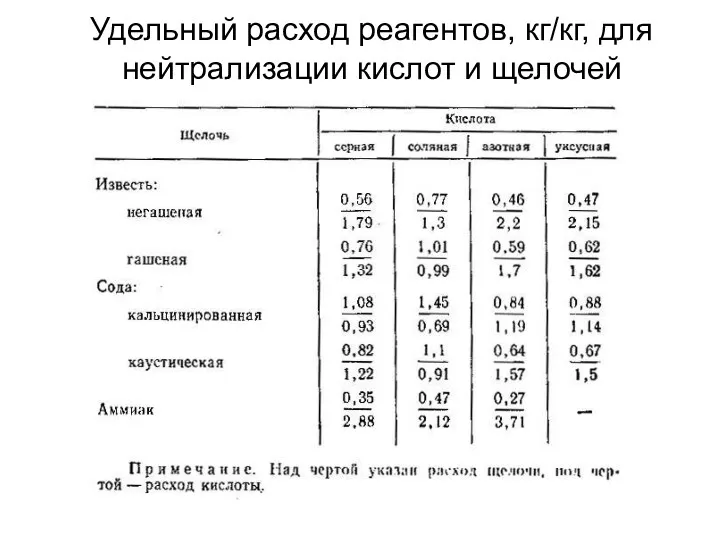
- 11. Удельный расход реагентов, кг/кг, для нейтрализации кислот и щелочей
- 12. Расчетное количество реагента с учетом осаждения ионов металлов
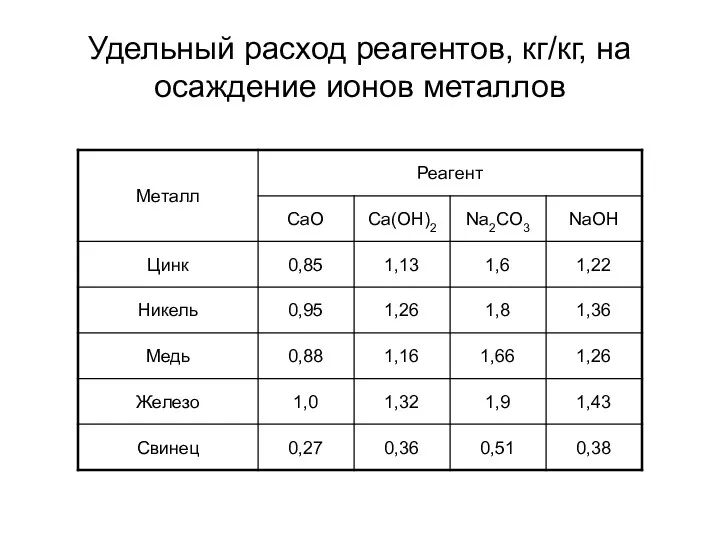
- 13. Удельный расход реагентов, кг/кг, на осаждение ионов металлов
- 14. Удельный объем осадка, %
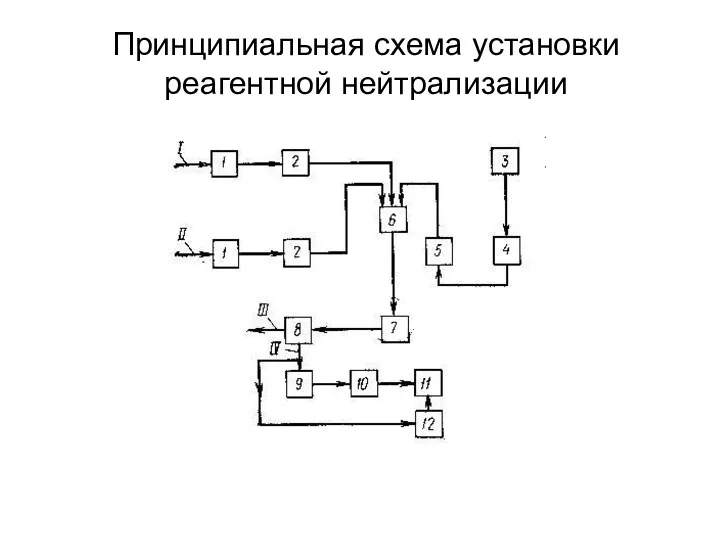
- 15. Принципиальная схема установки реагентной нейтрализации
- 16. Состав реагентного хозяйства: Склад реагента; Установка гашения извести; Установка приготовления рабочего раствора; Дозаторы. при сухом способе
- 17. Основные типы дозаторов Дозаторы постоянного расхода реагентов; Дозаторы подачи реагентов пропорционально расходу сточной воды; Дозаторы рассчитанные
- 18. 7.1.3. Нейтрализация вод фильтрованием через нейтрализующие материалы
- 19. Основные виды нейтрализующих материалов Доломит (CaCO3 · MgCO3); Известняк (CaCO3); Магнезит (MgCO3); Мел (CaCO3); Обожженый магнезит
- 20. Область применения фильтров отсутствие в воде солей металлов, т.к. при рН > 7 они выпадают в
- 21. Высота слоя загрузки
- 22. Площадь фильтрования Суточный расход загрузочного материала Фактический расход загрузочного материала
- 24. Скачать презентацию


















 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства