Содержание
- 2. План урока Теория электролитической диссоциации. I- е положение ТЭД. Задания к I-му положению ТЭД. II-е положение
- 3. 1. Теория электролитической диссоциации (ТЭД). 1887г. Сванте Аррениус
- 4. I-е положение ТЭД. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты
- 5. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 6. Задания к I-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества, которые
- 7. II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы. Процесс
- 9. Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды → гидратация → диссоциация. Вещества с ковалентной
- 10. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные
- 12. Скачать презентацию
 Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Темір және оның қосылыстары
Темір және оның қосылыстары Химическая связь
Химическая связь 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции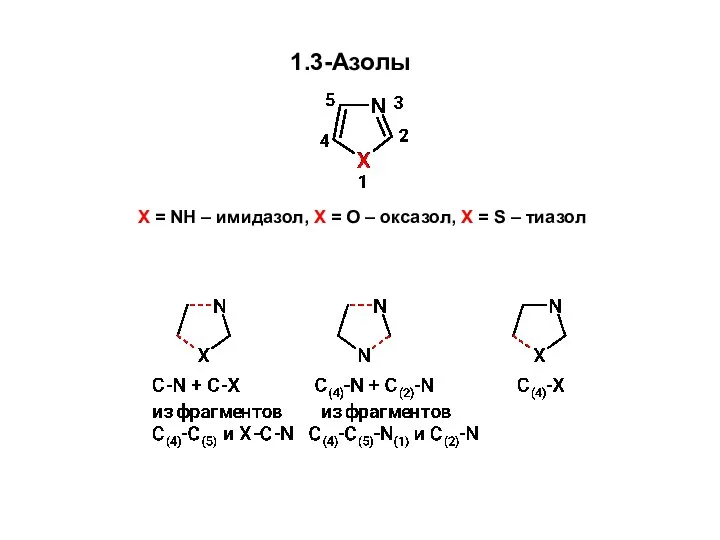 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение
Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение Класифікація та властивості оксидів
Класифікація та властивості оксидів Коррозия металлов
Коррозия металлов Строение атома. 10 ен
Строение атома. 10 ен Коррозия металлов
Коррозия металлов Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл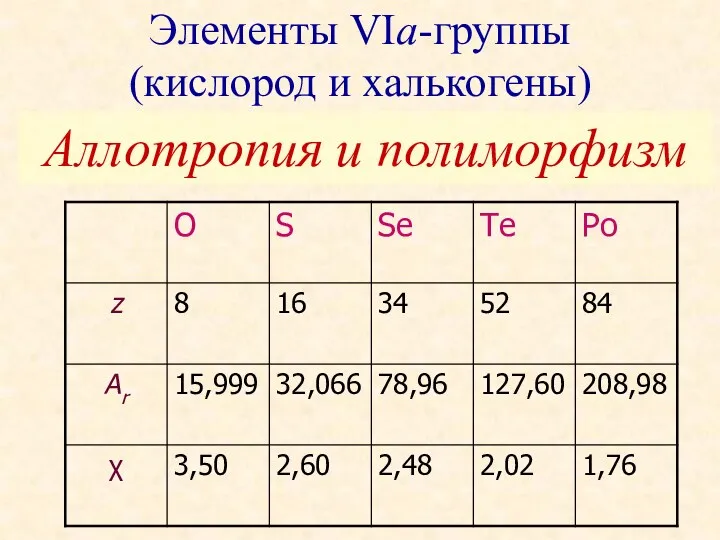 Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм
Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм Карбоновые кислоты
Карбоновые кислоты Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Мыло. Синтетические моющие средства.
Мыло. Синтетические моющие средства. Стратегия химической промышленности
Стратегия химической промышленности Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Спирты. Определение. Классификация
Спирты. Определение. Классификация