Содержание
- 2. Д.И. Менделеев «Мощь и сила науки во множестве фактов, цель – в обобщении этого множества»
- 3. «Типы химических реакций» Тема урока:
- 4. изучение типов химических реакций Цель урока:
- 5. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 6. Какие существуют типы химических реакций? Проблема:
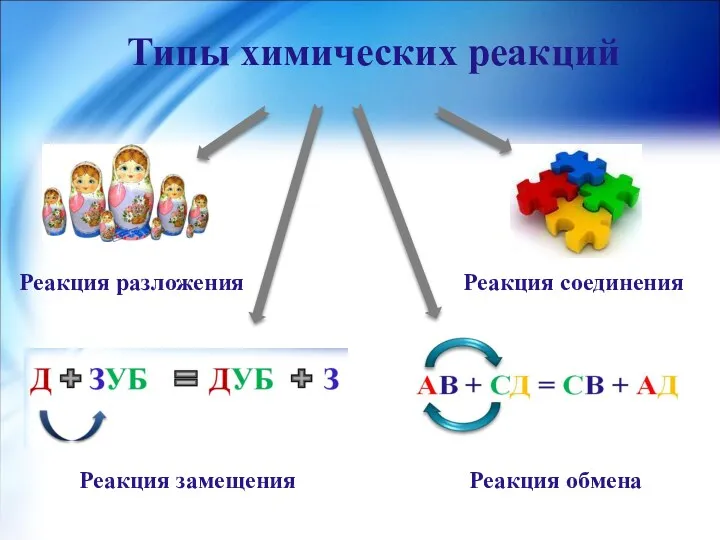
- 7. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 8. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 9. Лабораторный опыт № 1 Cu2(OH)2CO3 = 2CuO + CO2↑ + H2O 1) Данная реакция протекает при
- 10. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
- 11. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 12. Лабораторный опыт № 2 Fe + S → FeS 1) Данная реакция протекает при нагревании. 2)
- 13. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 14. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
- 15. Лабораторный опыт № 3 ↓ Fe + CuSO4 → FeSO4 + Cu Синий раствор Зеленый раствор
- 16. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 17. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 18. 1) Al + H2SO4 = 2) Zn + O2 = 3) Fe + HCl = 4)
- 19. § 21. Химия. 8 класс. Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, 2016. Упр. 1, 3
- 21. Скачать презентацию

















 Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химия в организме человека
Химия в организме человека Теплота горения
Теплота горения Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Технологическая установка Л 24-6
Технологическая установка Л 24-6 Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Амінокислоти
Амінокислоти Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Гидролиз солей
Гидролиз солей Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Химический элемент кремний
Химический элемент кремний Альдегиды и кетоны
Альдегиды и кетоны Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Organic chemistry. Alcohols
Organic chemistry. Alcohols Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Гидролиз солей
Гидролиз солей Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Органические вещества
Органические вещества Физические свойства минералов
Физические свойства минералов Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота