Содержание
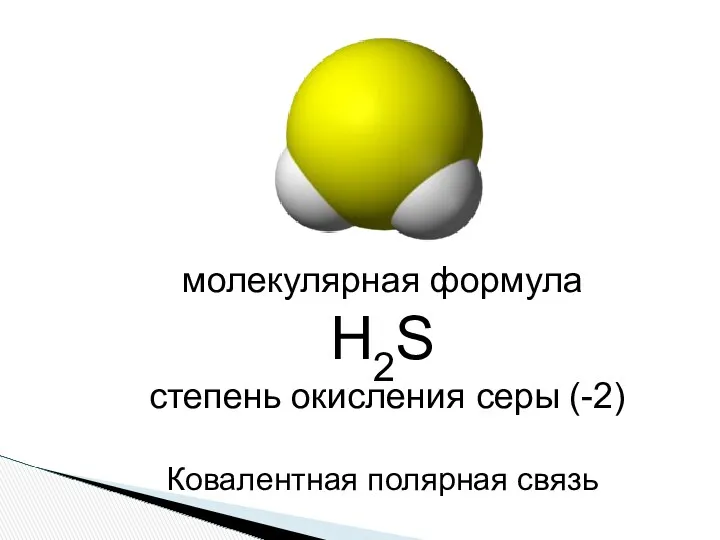
- 2. молекулярная формула Н2S степень окисления серы (-2) Ковалентная полярная связь
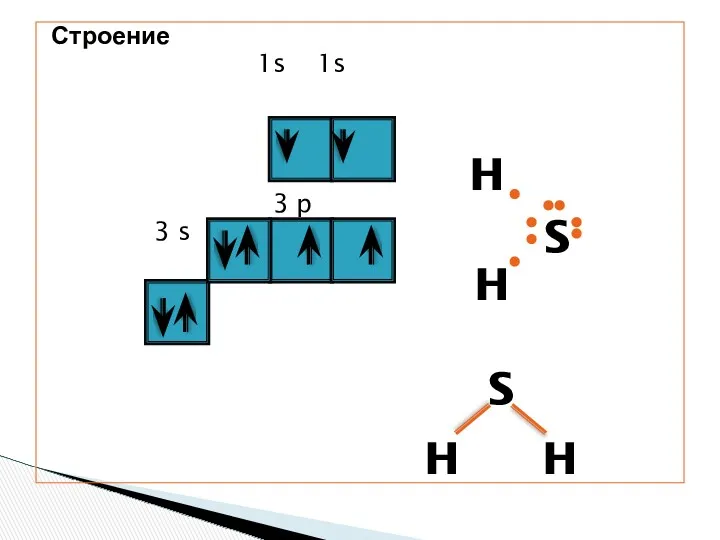
- 3. Строение 1s 1s 3 p 3 s H H S S H H
- 4. Молекула сероводорода имеет угловую форму, поэтому она полярна. В отличие от молекул воды, атомы водорода в
- 5. Нахождение в природе в свободном состоянии встречается в составе вулканических газов, во многих источниках вулканических местностей,
- 6. в растворенном и отчасти в свободном состоянии сероводород содержится в Черном море, начиная с глубины 200
- 7. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ
- 8. в небольших количествах он образуется всюду, где происходит разложение или гниение органических веществ: она присутствует в
- 9. Д воздух -? М(Воздух)= 29 г/моль М(H2S)= 34 г/моль Д воздух = 34:29=1,17 Д воздух =1,17
- 10. Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) 1. Бесцветный газ с запахом тухлых яиц и сладковатым вкусом. 2.
- 11. 1. В лаборатории сероводород получают взаимодействием сульфида железа с соляной или разбавленной серной кислотами: FeS +
- 12. 1 ступень H2S → H+ + HS- 2 ступень HS- ↔ H+ + S2- Диссоциация по
- 13. Взаимодействуют: - меняют окраску индикаторов -с основаниями -основными и амфотерными оксидами металлами солями Общие свойства кислот
- 14. H2S + NaOH → NaHS + H2O избыток H2S + 2NaOH → Na2S + 2H2O избыток
- 15. Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
- 16. Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор
- 17. Влияние сероводорода на окружающую среду и здоровье человека Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает
- 18. Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как
- 19. Сероводород применяют д для получения серной кислоты, элементной серы, сульфидов. В медицине — в составе природных
- 20. Сульфиды калия, стронция и бария используются в кожевенном деле для удаления шерсти со шкур перед их
- 23. Скачать презентацию


















 Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Водород
Водород Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей
Применение гибридного биосорбента для очистки промышленных сточных вод от радиоактивных примесей 5.Алкины
5.Алкины 20230419_soli
20230419_soli Щелочноземельные металлы
Щелочноземельные металлы драгоценные и поделочные
драгоценные и поделочные Установка гидрокрекинга
Установка гидрокрекинга Кислотные дожди
Кислотные дожди Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Комплексные соединения
Комплексные соединения Основные постулаты квантовой механики
Основные постулаты квантовой механики Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Гетероциклические соединения
Гетероциклические соединения Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Процессы сульфирования в промышленности
Процессы сульфирования в промышленности Химическая промышленность России
Химическая промышленность России Основные классы неорганических соединений
Основные классы неорганических соединений Химиялық элементтер
Химиялық элементтер Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Химический элемент цинк
Химический элемент цинк Значение периодического закона Д. И. Менделеева
Значение периодического закона Д. И. Менделеева Сахар - вред или польза?
Сахар - вред или польза? Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона
Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)