Содержание
- 2. Учебные материалы 1. Полный курс лекций и презентация 2. Вопросы – программы - МК (9), КР
- 3. ПРОЦЕССЫ СУЛЬФИРОВАНИЯ В ПРОМЫШЛЕННОСТИ Существуют разные способы введения сульфогрупп в молекулу органического соединения, но в промышленности
- 4. Основные сульфирующие агенты: 1.Безводная серная кислота (H2SO4). 2.Олеум - образуется при растворении серного ангидрида в концентрированной
- 5. Основные методы сульфирования: 1.Сульфирование концентрированной серной кислотой 2.Сульфирование серным ангидридом 3.Сульфирование олеумом 4.Сульфирование растворами серного ангидрида
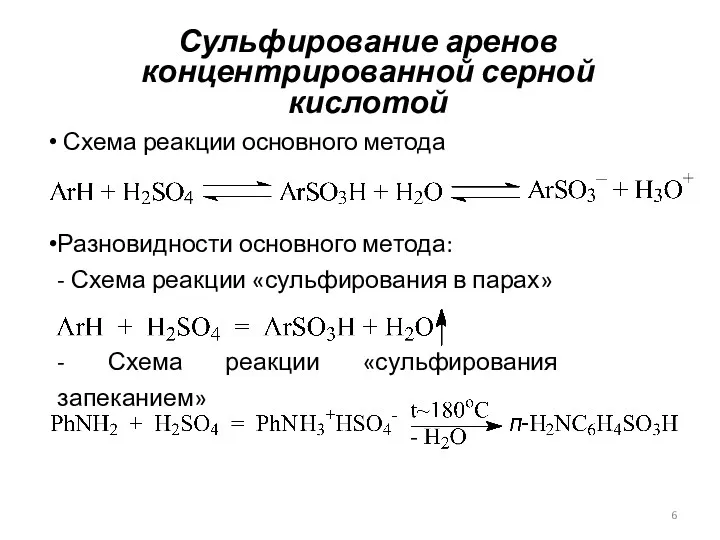
- 6. Сульфирование аренов концентрированной серной кислотой Схема реакции основного метода Разновидности основного метода: - Схема реакции «сульфирования
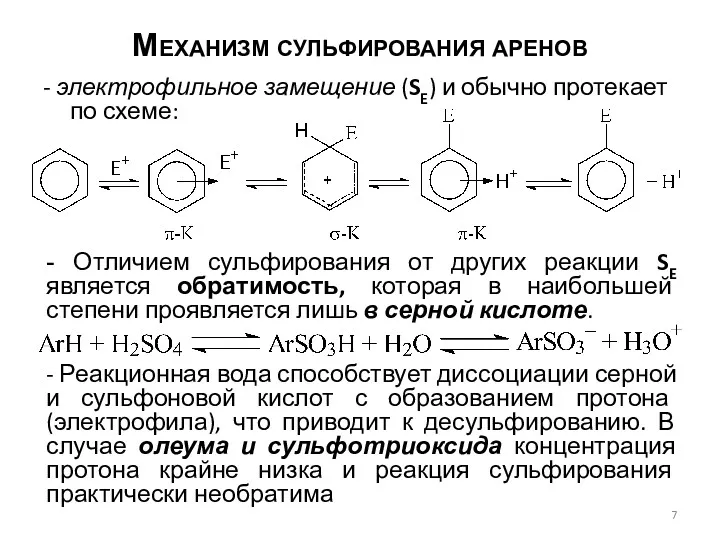
- 7. Механизм сульфирования аренов - электрофильное замещение (SE) и обычно протекает по схеме: - Отличием сульфирования от
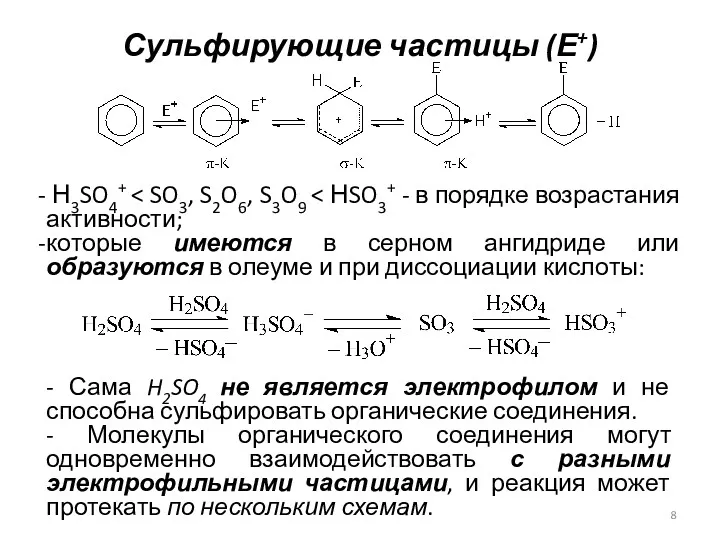
- 8. Сульфирующие частицы (Е+) Н3SO4+ которые имеются в серном ангидриде или образуются в олеуме и при диссоциации
- 9. Скорость и направление реакции в большой степени определяется, устойчивостью σ-комплекса т. е. строением субстрата (кинетический фактор),
- 10. Тепловой эффект сульфирования аренов серной кислотой, рассчитанный по закону Гесса, ~ 73 кДж/моль (является суммой экзотермического
- 11. Особенности сульфирования серной кислотой. Реакционная вода 1.Сульфирование серной кислотой, обычно, протекает как гомогенная реакция. 2. Кислота
- 12. - «π-Сульфирования» (πс) - минимальную концентрацию серной кислоты (выраженную в % SO3), при которой она еще
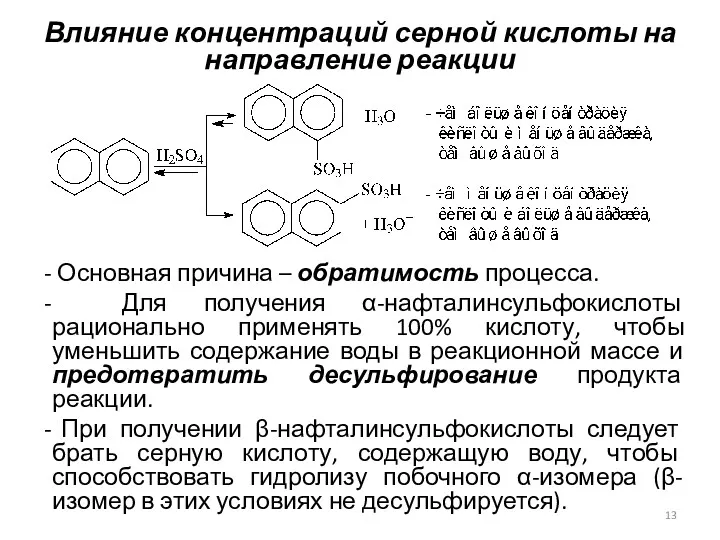
- 13. Влияние концентраций серной кислоты на направление реакции Основная причина – обратимость процесса. Для получения α-нафталинсульфокислоты рационально
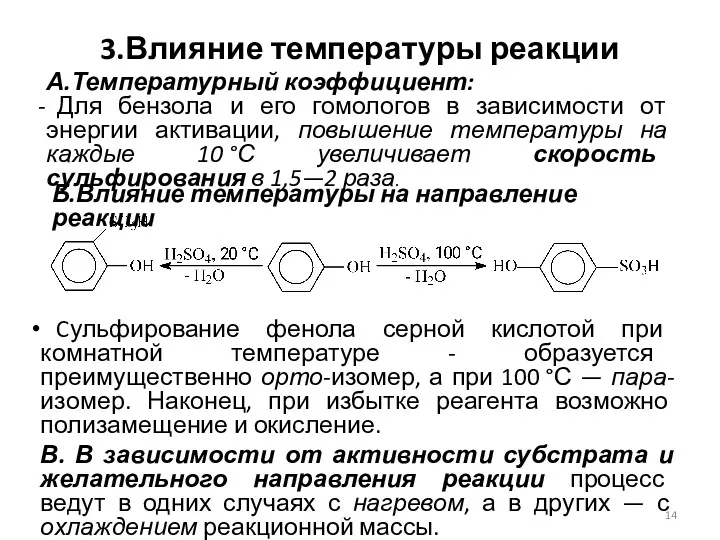
- 14. 3.Влияние температуры реакции Cульфирование фенола серной кислотой при комнатной температуре - образуется преимущественно орто-изомер, а при
- 15. Основные недостатки сульфирования H2SO4 : 1.Малая концентрация электрофильных частиц; 2.Быстрое снижение скорости реакции (вследствие разбавления кислоты
- 16. «Сульфирование в парах» - предполагает азеотропную отгонку воды из реакционной массы, либо с избытком летучего субстрата
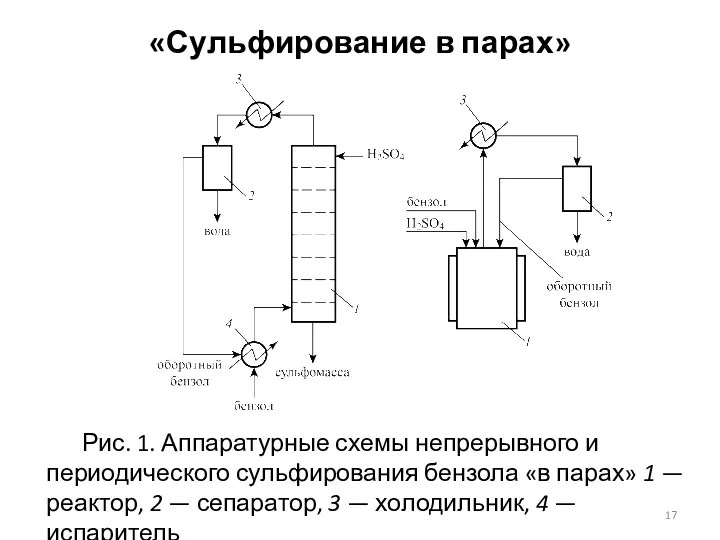
- 17. «Сульфирование в парах» Рис. 1. Аппаратурные схемы непрерывного и периодического сульфирования бензола «в парах» 1 —
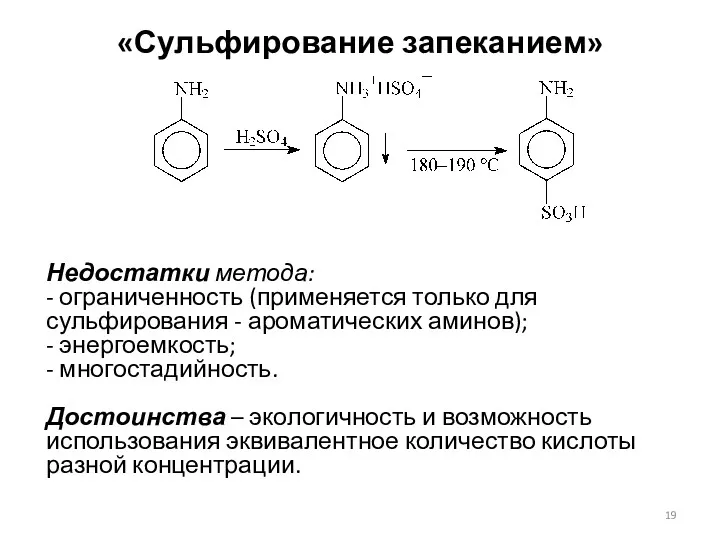
- 18. «Сульфирование запеканием» Применяют для сульфирования ароматических аминов. Сначала из амина и разбавленной серной кислоты получают соль,
- 19. «Сульфирование запеканием» Недостатки метода: - ограниченность (применяется только для сульфирования - ароматических аминов); - энергоемкость; -
- 20. Способы выделения аренсульфокислот. Химизм Сульфокислоты обычно хорошо растворяются в сульфомассе, поэтому их чаще всего выделяют в
- 21. Технология выделения аренсульфокислот Образующиеся соли могут находиться в одной фазе (в растворе или в осадке), поэтому
- 22. Технология выделения аренсульфокислот - Мел и известь - дешевое сырье, а кальциевые соли сульфокислот, как правило,
- 23. Сульфирование олеумом и серным ангидридом - Методы отличаются универсальностью и большой активностью, которая сохраняется до конца
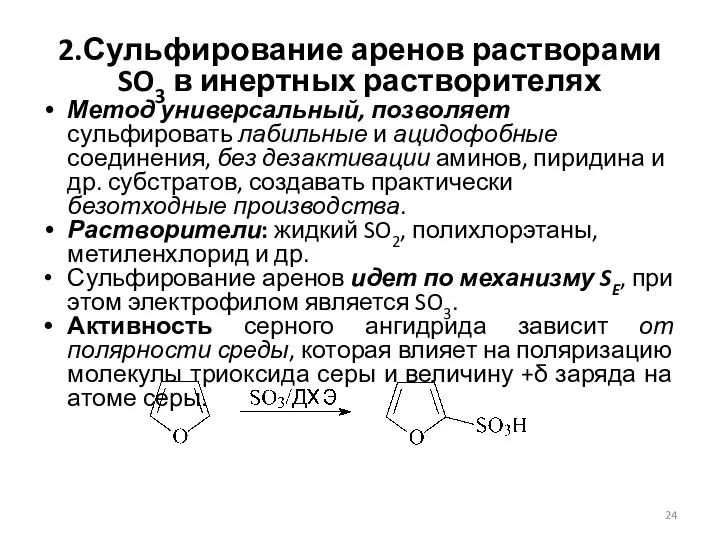
- 24. 2.Сульфирование аренов растворами SO3 в инертных растворителях Метод универсальный, позволяет сульфировать лабильные и ацидофобные соединения, без
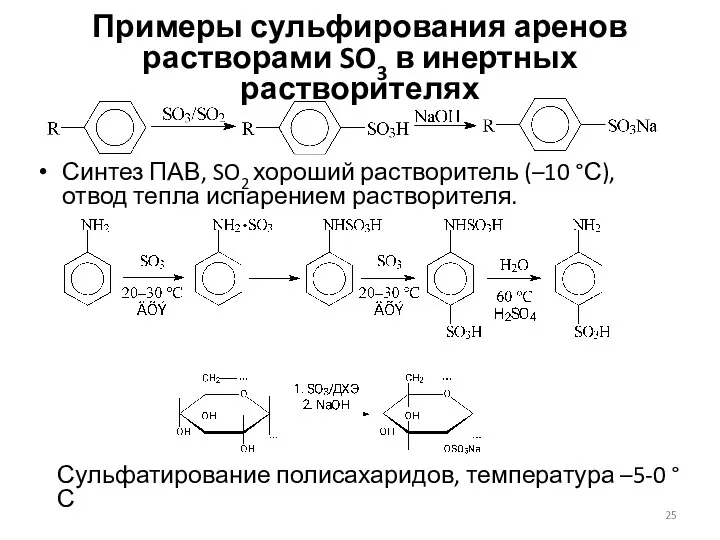
- 25. Примеры сульфирования аренов растворами SO3 в инертных растворителях Синтез ПАВ, SO2 хороший растворитель (–10 °С), отвод
- 27. Скачать презентацию















 Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Табиғи нанокристалдар
Табиғи нанокристалдар Кислоты 8 класс
Кислоты 8 класс Летучие яды
Летучие яды Тепловой эффект химических реакций
Тепловой эффект химических реакций Химическая связь. 8 класс
Химическая связь. 8 класс Товары бытовой химии
Товары бытовой химии Химическая промышленность
Химическая промышленность Топливо. Виды топлива
Топливо. Виды топлива Тканые армирующие наполнители
Тканые армирующие наполнители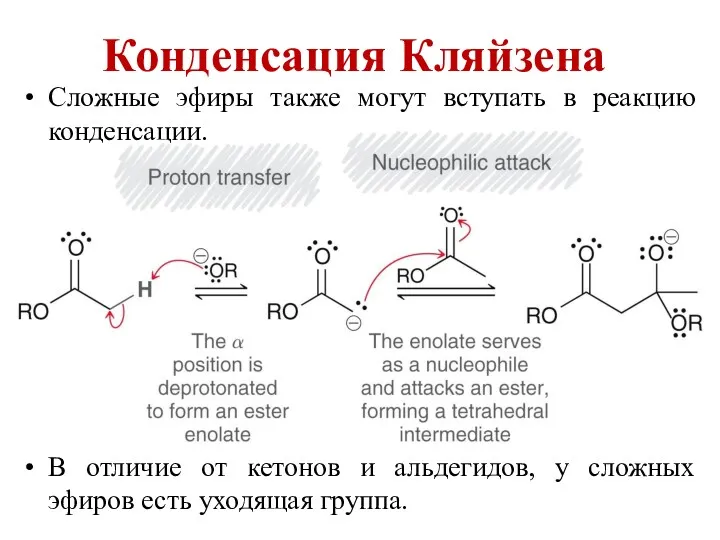 Конденсация Кляйзена
Конденсация Кляйзена Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Химическая термодинамика
Химическая термодинамика Как и где используется соляная кислота
Как и где используется соляная кислота Аммиак
Аммиак Элементы подгруппы углерода
Элементы подгруппы углерода Применение жиров
Применение жиров А.М. Бутлеровтың химиялык кұрылыс теориясы
А.М. Бутлеровтың химиялык кұрылыс теориясы Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Полисахариды. Крахмал
Полисахариды. Крахмал Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Оксиды
Оксиды Алкалоиды: распространение в природе, получение, применение, способы синтеза
Алкалоиды: распространение в природе, получение, применение, способы синтеза Электролиз
Электролиз Возникновение и развитие органической химии. Теория химического строения. Структурные формулы
Возникновение и развитие органической химии. Теория химического строения. Структурные формулы Цинк
Цинк