Содержание
- 2. H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42- Кислоты
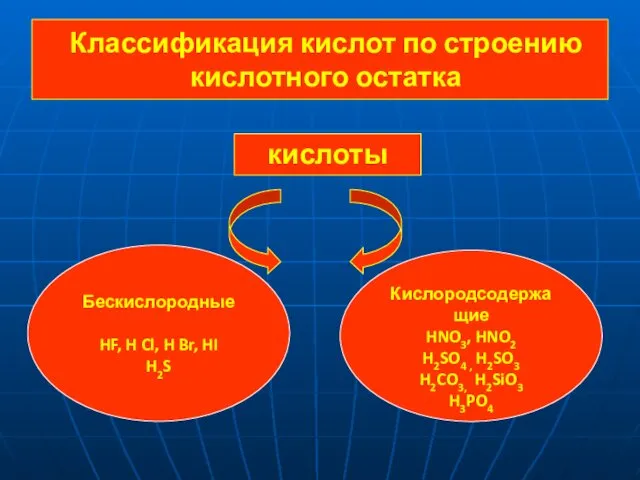
- 3. Классификация кислот по строению кислотного остатка кислоты Бескислородные HF, H Cl, H Br, HI H2S Кислородсодержащие
- 4. Состав кислот H Cl H2SO4 H3PO4 1. Кислоты – это простые или сложные вещества? 2. Что
- 5. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
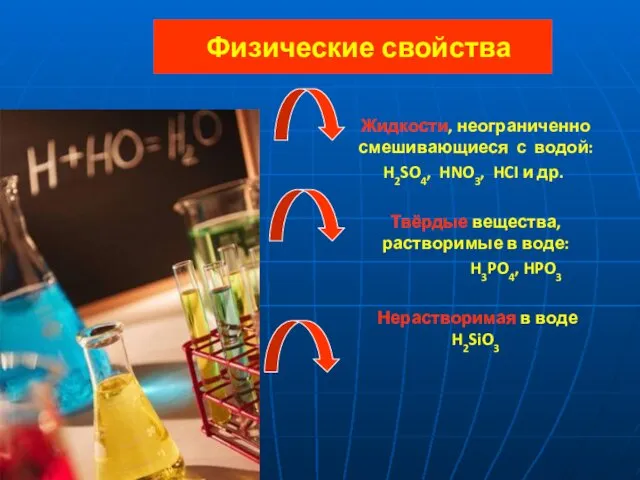
- 6. Физические свойства Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в
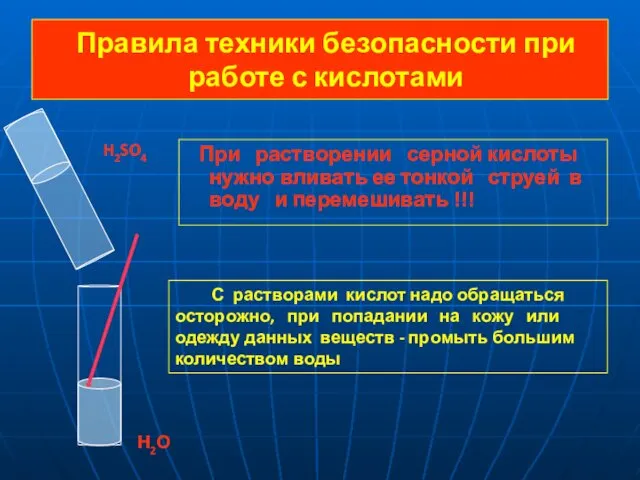
- 7. Правила техники безопасности при работе с кислотами При растворении серной кислоты нужно вливать ее тонкой струей
- 8. Действие кислот на растворы индикаторов фиолетовый красный оранжевый розовый лакмус метилоранж обусловлено наличием в них ионов
- 9. Взаимодействие кислот с металлами Zn + 2 HCI = ZnCI2 + H2 + Q Zn +2H+
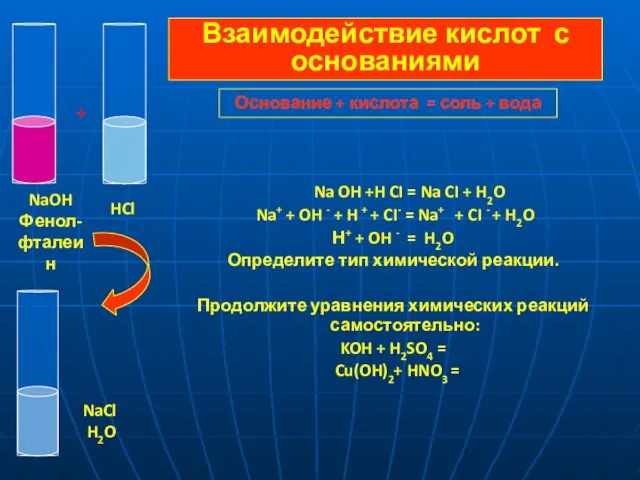
- 10. Na OH +H CI = Na CI + H2O Na+ + OH - + H +
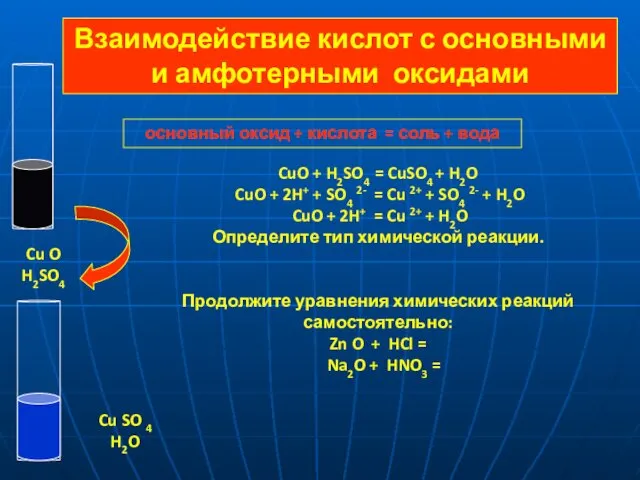
- 11. основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O CuO
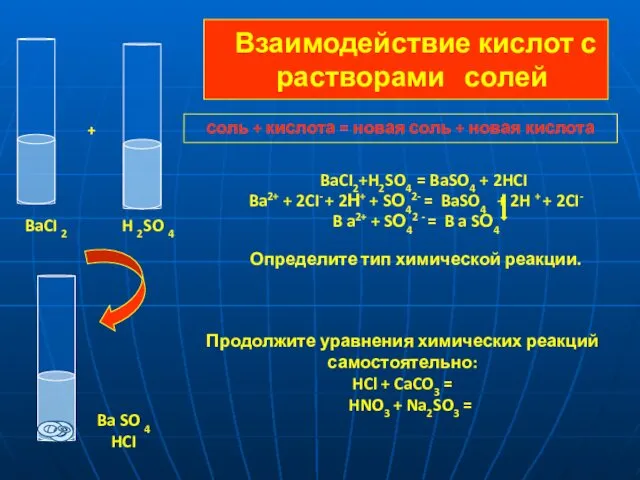
- 12. Взаимодействие кислот с растворами солей BaCI2+H2SO4 = BaSO4 + 2HCI Ba2+ + 2CI- + 2Н+ +
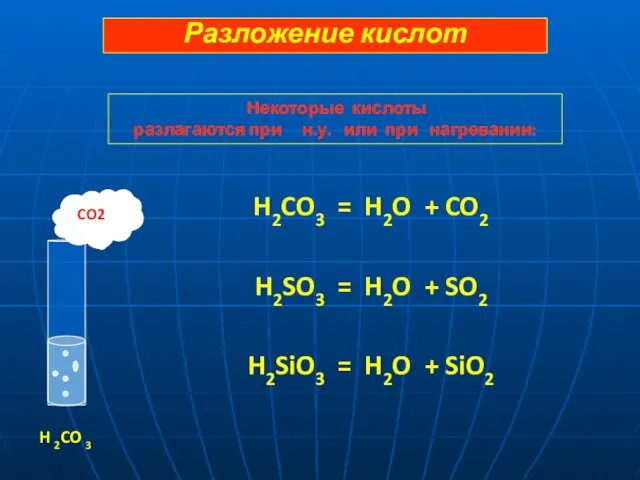
- 13. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2 H2SiO3 = H2O + SiO2 CO2
- 14. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой: P2O5+ 3H2O = 2H3PO4 SO3 + H2O
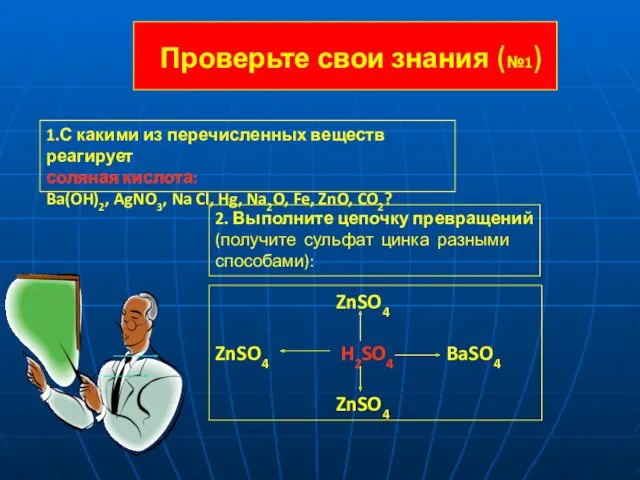
- 15. Проверьте свои знания (№1) 1.С какими из перечисленных веществ реагирует соляная кислота: Ba(OH)2, AgNO3, Na Cl,
- 17. Скачать презентацию






 Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Купрум. Знаходження в періодичній системі
Купрум. Знаходження в періодичній системі Хром. Свойства
Хром. Свойства Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Горение жидкостей
Горение жидкостей Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии Водород. Н2
Водород. Н2 Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ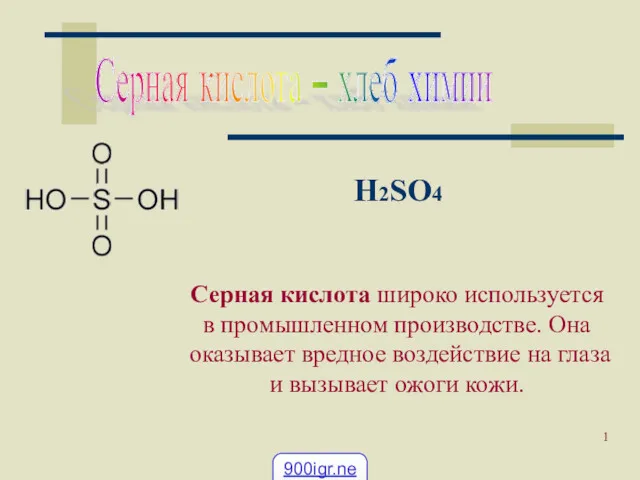 Применение серной кислоты
Применение серной кислоты Органическая химия
Органическая химия Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Незвичайна вода
Незвичайна вода Загрязнение продуктов питания
Загрязнение продуктов питания Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Түсті металдар
Түсті металдар Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ
Окисление перманганатом и бихроматом калияорганических соединений. Уровень ЕГЭ Теплота сгорания топлива
Теплота сгорания топлива Сера
Сера История нефти. Свойства нефти. Классификация нефтей
История нефти. Свойства нефти. Классификация нефтей Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури
Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури Химия лекция (вебинар)
Химия лекция (вебинар) Оксид серы (VI). Серная кислота
Оксид серы (VI). Серная кислота Хром
Хром Продукция UNIL
Продукция UNIL Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук