Содержание
- 2. Бром (от др.-греч. βρῶμος — «зловонный») — химический элемент с атомным номером 35. Принадлежит к 17-й
- 3. Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом[en] (нем. Carl Jacob Löwig) в 1825 году,
- 4. Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов: MgBr2
- 5. Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой: 5NaBr +
- 6. Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти
- 7. Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома
- 8. В качестве исходного сырья для производства брома служат: Морская вода (65 мг/л) Рассолы соляных озёр Щёлок
- 9. Летучая жидкость красно-бурого цвета Сильный неприятный «тяжелый» запах Плотность - 3,102 (25 °C) г/см³ Температура плавления
- 10. Бром немного, но лучше других галогенов растворим в воде (3,58 г на 100 г воды при
- 11. С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических
- 12. В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного йода, серу
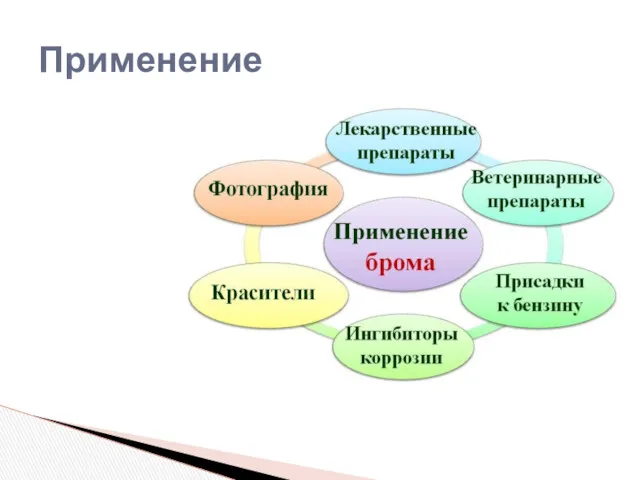
- 13. Применение
- 14. Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до
- 15. В начале 20 в. открылась новая область применения брома. С распространением автомобилей появилась нужда в больших
- 16. Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества,
- 18. Скачать презентацию

![Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом[en] (нем.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/156988/slide-2.jpg)












 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи