Содержание
- 2. Фтор (F, лат. fluorum) — химический элемент 7(17)-й группы, второго периода периодической системы с атомным номером
- 3. Польза фтора Фтор – важный участник минерального обмена. Он влияет на рост волос, прочность и общее
- 4. Влияние фтора на мозг Несмотря на все свои положительные свойства, фтор способен серьёзно навредить здоровью человека.
- 5. История Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под
- 6. Физические свойства При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах
- 7. Применение Фтор используется для получения: фреонов — широко распространённых хладагентов; фторопластов — химически инертных полимеров; элегаза
- 9. Скачать презентацию
Слайд 2
Фтор (F, лат. fluorum) — химический элемент 7(17)-й группы, второго периода периодической системы с атомным номером 9. Самый химически
Фтор (F, лат. fluorum) — химический элемент 7(17)-й группы, второго периода периодической системы с атомным номером 9. Самый химически
активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Слайд 3
Польза фтора
Фтор – важный участник минерального обмена. Он влияет на рост
Польза фтора
Фтор – важный участник минерального обмена. Он влияет на рост
волос, прочность и общее здоровье костей. Воздействие фтористых соединений широко рассматривается в вопросах стоматологии.
Полезные свойства:
Вместе с кальцием укрепляет эмаль,
Помогает кроветворным процессам,
Выводит радионуклиды,
Тормозит развитие остеопороза,
Усиливает иммунную систему,
Участвует в ферментативных и биохимических реакциях,
Помогает усваивать железо,
Ускоряет сращивание костей,
Предотвращает кариес и пародонтоз.
Недостаток опасен, так как приводит к хрупкости костных тканей. Это проявляется выпадением волос, ломкостью ногтей и слабостью костей. У людей появляется кариес, что особенно сильно заметно у детей. Плохое усвоение железа приводит к развитию железодефицитной анемии.
Чтобы покрыть суточную норму данного вещества, достаточно получать его в количестве 0,5-4 мг. Для этого нужно есть продукты вроде отрубей, гречневой, рисовой и овсяной каши, картофеля и лука. Среди пищи животного происхождения приоритет отдается печени, молоку, яйцам и мясу. Фтор содержится в орехах вроде арахиса, фундука и фисташек.
Полезные свойства:
Вместе с кальцием укрепляет эмаль,
Помогает кроветворным процессам,
Выводит радионуклиды,
Тормозит развитие остеопороза,
Усиливает иммунную систему,
Участвует в ферментативных и биохимических реакциях,
Помогает усваивать железо,
Ускоряет сращивание костей,
Предотвращает кариес и пародонтоз.
Недостаток опасен, так как приводит к хрупкости костных тканей. Это проявляется выпадением волос, ломкостью ногтей и слабостью костей. У людей появляется кариес, что особенно сильно заметно у детей. Плохое усвоение железа приводит к развитию железодефицитной анемии.
Чтобы покрыть суточную норму данного вещества, достаточно получать его в количестве 0,5-4 мг. Для этого нужно есть продукты вроде отрубей, гречневой, рисовой и овсяной каши, картофеля и лука. Среди пищи животного происхождения приоритет отдается печени, молоку, яйцам и мясу. Фтор содержится в орехах вроде арахиса, фундука и фисташек.
Слайд 4
Влияние фтора на мозг
Несмотря на все свои положительные свойства, фтор способен
Влияние фтора на мозг
Несмотря на все свои положительные свойства, фтор способен
серьёзно навредить здоровью человека. В 2006 году британский журнал The Lancet опубликовал результаты исследования, в которых было выявлена взаимосвязь между данным веществом и серьёзными повреждениями головного мозга.
Вред фторидов был окончательно подтверждён месяц спустя американской газетой Environmental Health Perspectives. Опасность во многом обусловлена влиянием на шишковидную железу (эпифиз), которая располагается в центре мозга. В теории, элемент способен полностью нейтрализовать её и разрушить, будто бы бетонируя.
Доказано, что фтор в больших количествах сокращает уровень IQ. Это может быть связано с тем, что шишковидная железа вырабатывает мелатонин, который связан с мыслительными функциями.
Вред фторидов был окончательно подтверждён месяц спустя американской газетой Environmental Health Perspectives. Опасность во многом обусловлена влиянием на шишковидную железу (эпифиз), которая располагается в центре мозга. В теории, элемент способен полностью нейтрализовать её и разрушить, будто бы бетонируя.
Доказано, что фтор в больших количествах сокращает уровень IQ. Это может быть связано с тем, что шишковидная железа вырабатывает мелатонин, который связан с мыслительными функциями.
Слайд 5
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под
названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 годуэлектролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Как химический элемент, входящий в состав плавиковой кислоты фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 годуэлектролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Слайд 6
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях
в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[3]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[3]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета
Слайд 7
Применение
Фтор используется для получения:
фреонов — широко распространённых хладагентов;
фторопластов — химически инертных полимеров;
элегаза SF6 — газообразного изолятора, применяемого в
Применение
Фтор используется для получения:
фреонов — широко распространённых хладагентов;
фторопластов — химически инертных полимеров;
элегаза SF6 — газообразного изолятора, применяемого в
высоковольтной электротехнике;
гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;.
гексафтороалюмината натрия — электролита для получения алюминия электролизом;
фторидов металлов, которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах.
Применение в медицине[править | править код]
Основная статья: Соединения фтора в медицине
Фторированные углеводороды применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре .Фториды натрия, калия и др. применяются для профилактики кариеса.
гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;.
гексафтороалюмината натрия — электролита для получения алюминия электролизом;
фторидов металлов, которые обладают некоторыми полезными свойствами;
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах.
Применение в медицине[править | править код]
Основная статья: Соединения фтора в медицине
Фторированные углеводороды применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре .Фториды натрия, калия и др. применяются для профилактики кариеса.
- Предыдущая
B13. Задачи на концентрацию и сплавы




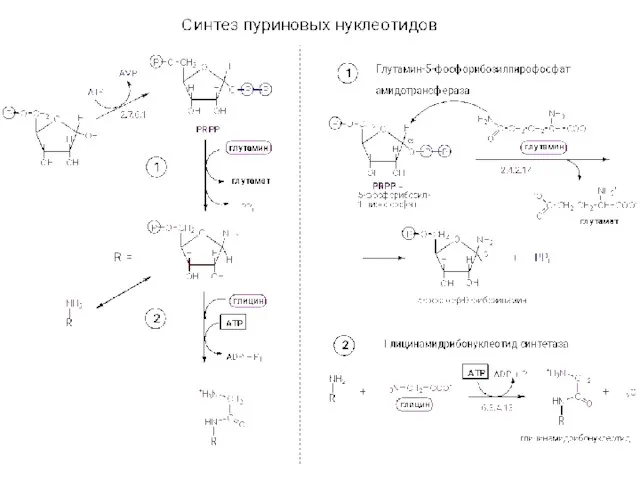 Синтез нуклеотидов
Синтез нуклеотидов Текстуры и структуры метаморфических горных пород
Текстуры и структуры метаморфических горных пород Иондық байланыс
Иондық байланыс драгоценные и поделочные
драгоценные и поделочные Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло История нефти. Свойства нефти. Классификация нефтей
История нефти. Свойства нефти. Классификация нефтей Химическая термодинамика
Химическая термодинамика Химическая промышленность
Химическая промышленность Кислотно-основные свойства органических соединений. (Лекция 3)
Кислотно-основные свойства органических соединений. (Лекция 3) Химические свойства серной кислоты
Химические свойства серной кислоты ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Скорость химической реакции
Скорость химической реакции Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее?
Иccледовательская работа по химии красное, желтое ,зеленое, какое полезнее? Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Гниение. Брожение
Гниение. Брожение Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар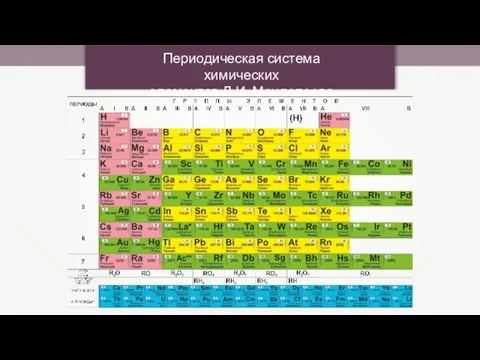 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева The production of stable isotopes
The production of stable isotopes Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Металлические стёкла
Металлические стёкла Установка по переработке углеводородов
Установка по переработке углеводородов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Дифузія в побуті
Дифузія в побуті Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен зандары. Термохимиялық есептеулер