Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
- 3. Строение вещества
- 4. Электронная микроскопия Изображение атомной решётки плёнки золота. Расстояние между кристаллографическими плоскостями 2,04 Å.
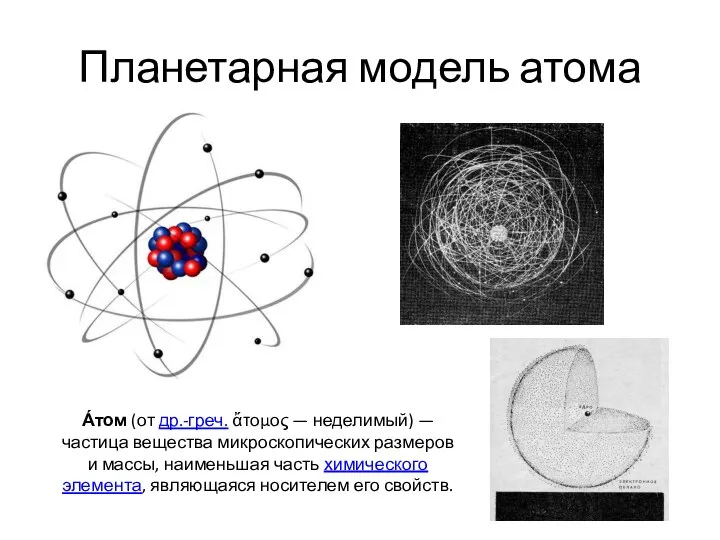
- 5. Планетарная модель атома А́том (от др.-греч. ἄτομος — неделимый) — частица вещества микроскопических размеров и массы,
- 6. Атом Атом состоит из атомного ядра и электронов. Атомное ядро несет 99,9% массы атома. Состоит из
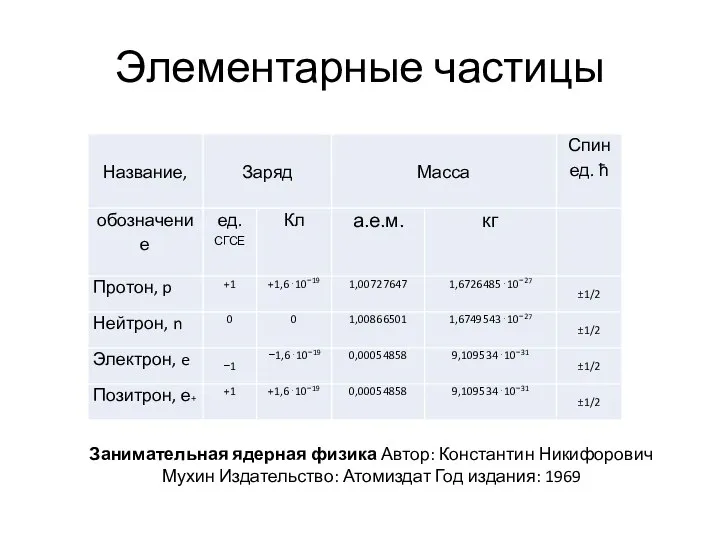
- 7. Элементарные частицы Занимательная ядерная физика Автор: Константин Никифорович Мухин Издательство: Атомиздат Год издания: 1969
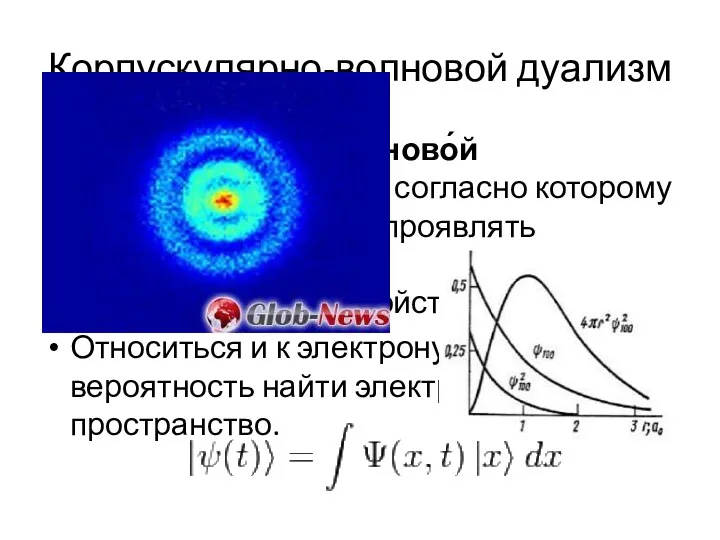
- 8. Корпускулярно-волновой дуализм Корпускуля́рно-волново́й дуали́зм — принцип, согласно которому любой объект может проявлять как волновые, так и
- 9. Химические элементы Химическое вещество – субстанция с одинаковыми химическими и физическими свойствами. Сера Железо Азотная кислота
- 10. Свойства атома определяются количеством электронов Количество электронов равно количеству протонов. Химические элементы – частицы с одинаковым
- 11. Химические элементы Сера Железо Азотная кислота S 16 – протонов Fe 26 – протонов HNO3 H
- 13. Изотопы и изобары Частицы одного элемента с различным массовым числом называют изотопами. Частицы с одинаковыми массовыми
- 14. Изотопы водорода Радиоактивные изотопы – нестабильные изотопы, которые самопроизвольно распадаются. Протий, Дейтерий, Тритий, H2O D2O Т2О
- 15. Изобары с массовым числом 3 3T – тритий 3He - гелий 1 протон + 2 нейтрона
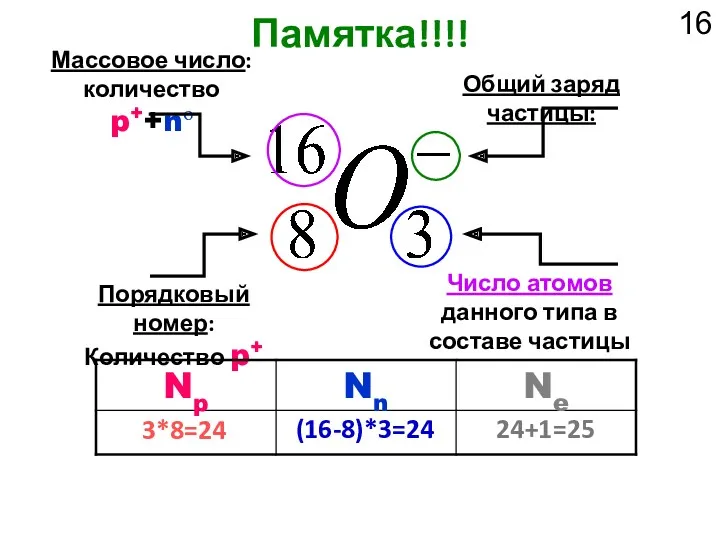
- 16. Памятка!!!! Массовое число: количество p++nо Порядковый номер: Количество p+ Число атомов данного типа в составе частицы
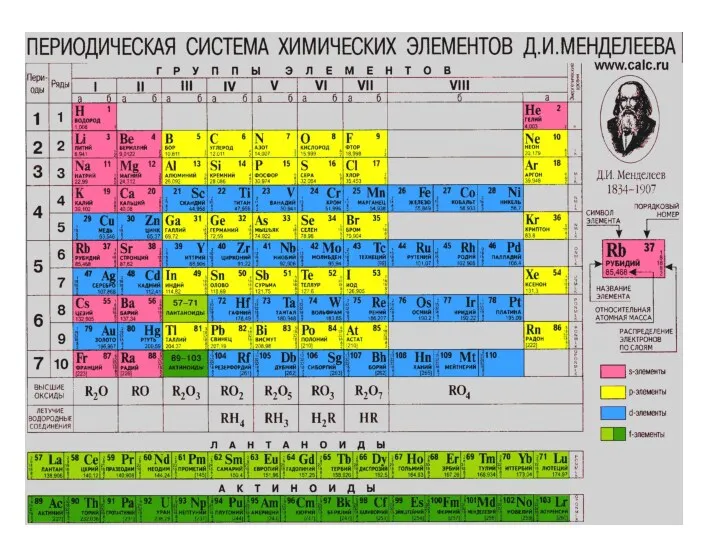
- 17. ЗАДАНИЕ №1 Выучит наизусть символы, русские и латинские наименования всех элементов с 1 по 92. Проверка
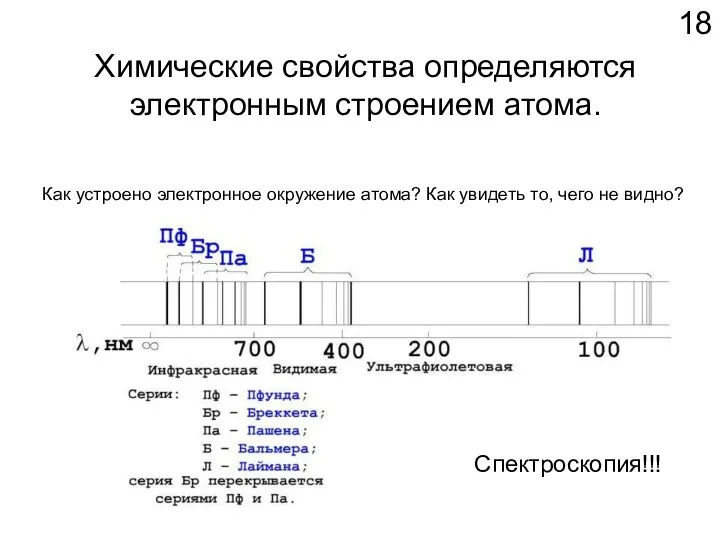
- 18. Химические свойства определяются электронным строением атома. Как устроено электронное окружение атома? Как увидеть то, чего не
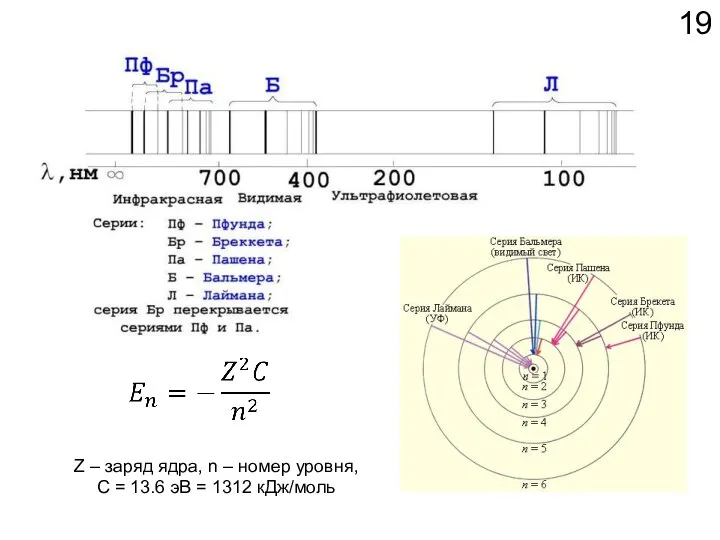
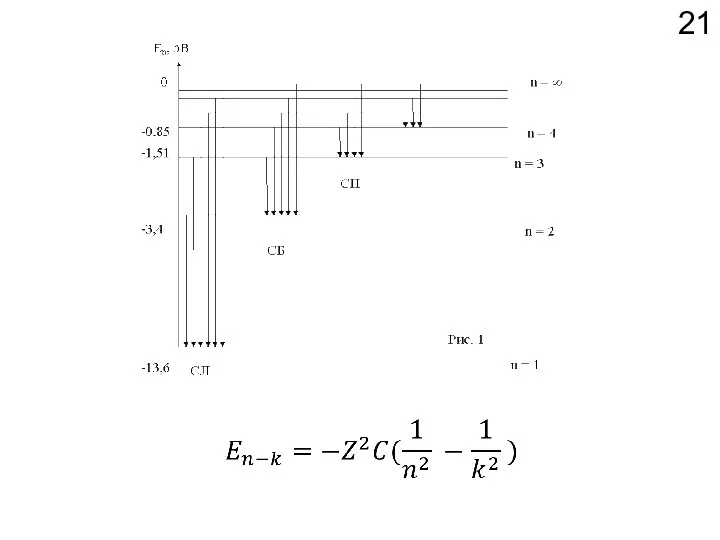
- 19. Z – заряд ядра, n – номер уровня, С = 13.6 эВ = 1312 кДж/моль
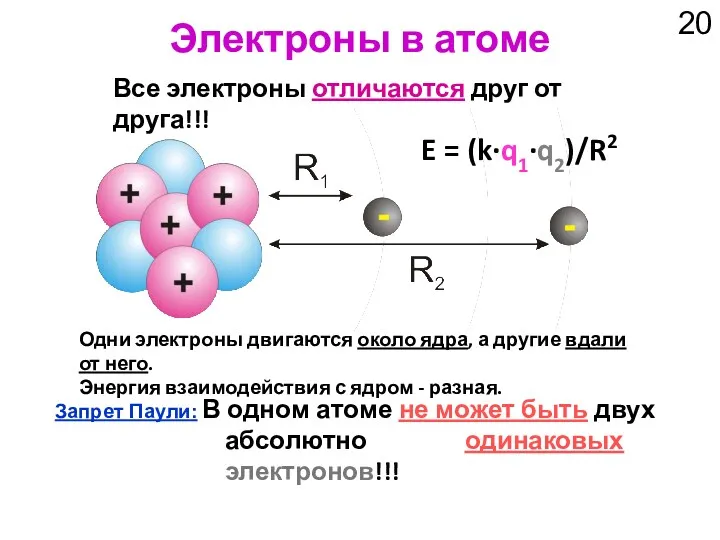
- 20. Электроны в атоме Все электроны отличаются друг от друга!!! Запрет Паули: В одном атоме не может
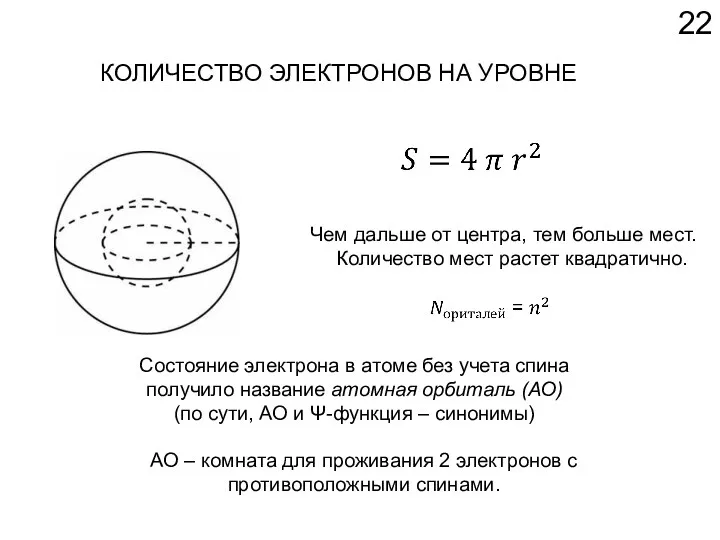
- 22. КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА УРОВНЕ Чем дальше от центра, тем больше мест. Количество мест растет квадратично. Состояние
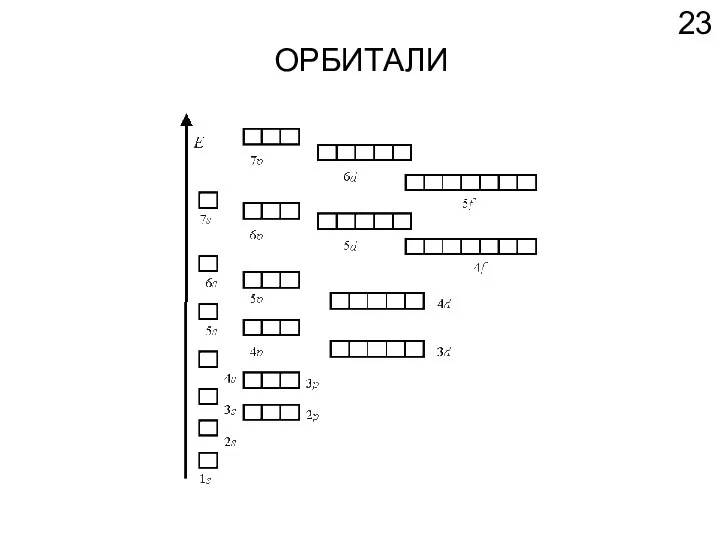
- 23. ОРБИТАЛИ
- 24. Название Электроны в атоме Каждый электрон в атоме характеризуется четырьмя квантовыми числами Принцип Паули: в одном
- 25. Орбитальное число ℓ Электроны в атоме Главное квантовое число n: 1. Характеризует энергию взаимодействия электрона с
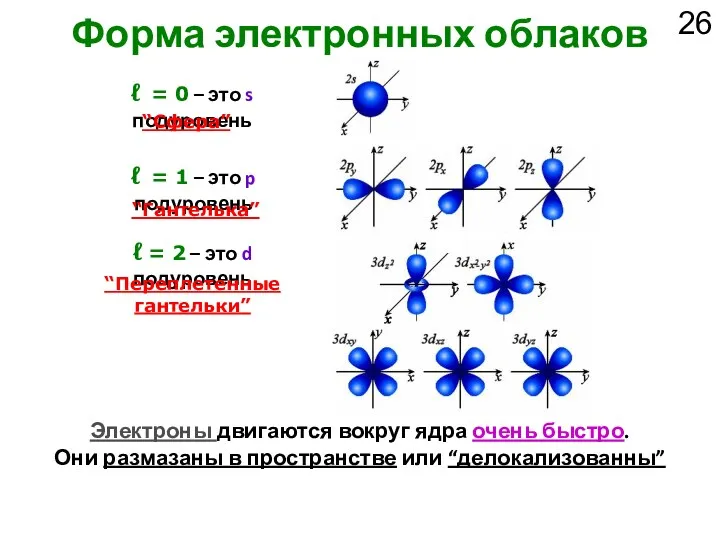
- 26. Форма электронных облаков Электроны двигаются вокруг ядра очень быстро. Они размазаны в пространстве или “делокализованны” ℓ
- 27. Магнитное число (от -ℓ до +ℓ) Электроны в атоме Магнитное квантовое число m: 1. Характеризует ориентацию
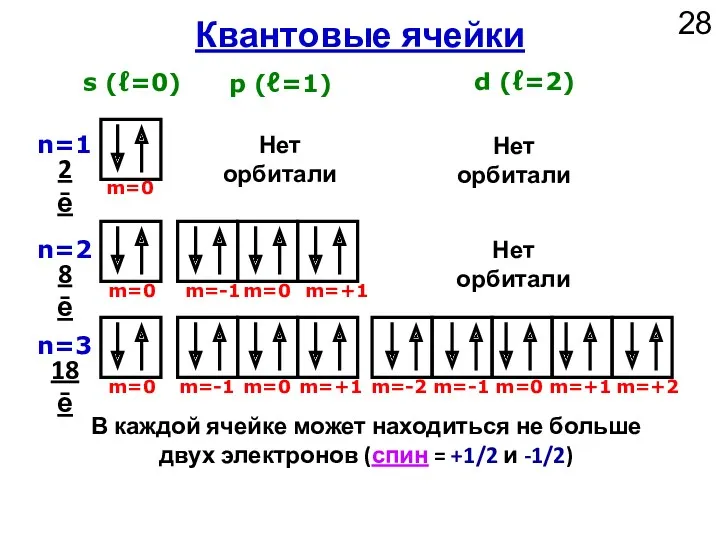
- 28. n=1 n=2 n=3 s (ℓ=0) p (ℓ=1) d (ℓ=2) Квантовые ячейки m=0 m=0 m=0 m=0 m=-1
- 29. Заполнение электронной оболочки Ядро Электроны – заполняют оболочку по определенным правилам!!!
- 30. Заполнение электронной оболочки Правила заполнения орбиталей электронами: Принцип минимальной энергии В первую очередь заполняются орбитали, у
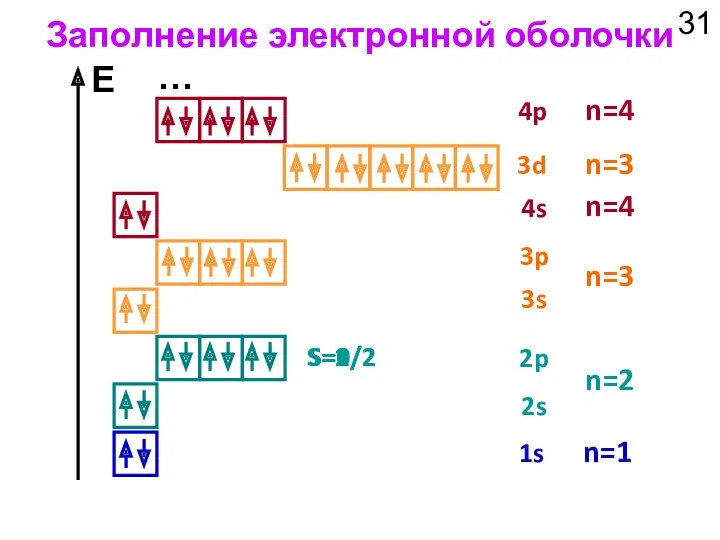
- 31. Заполнение электронной оболочки 1s 2s 2p 3s 3p 4s 3d 4p E … S=1/2 S=1 S=3/2
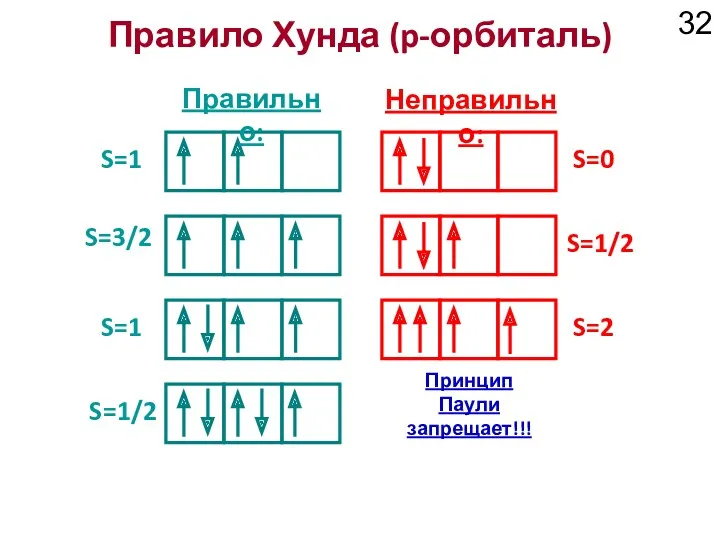
- 32. Правило Хунда (p-орбиталь) S=1 Правильно: Неправильно: S=3/2 S=0 S=1/2 S=1 S=2 S=1/2 Принцип Паули запрещает!!!
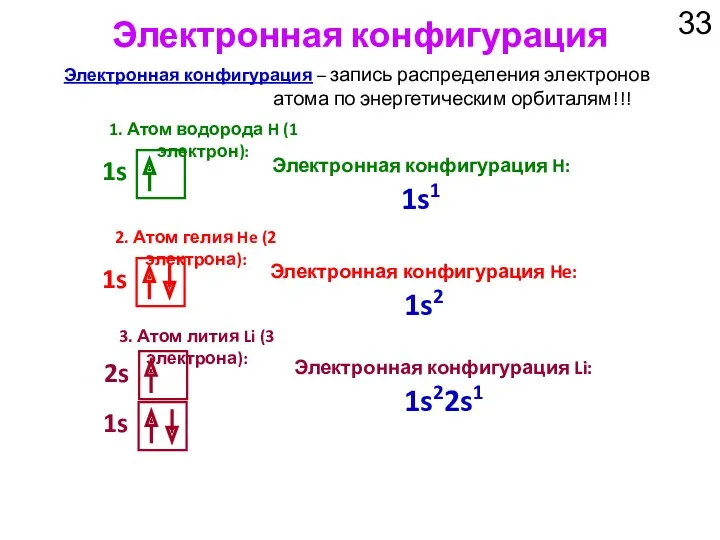
- 33. Электронная конфигурация 1. Атом водорода H (1 электрон): 1s Электронная конфигурация – запись распределения электронов атома
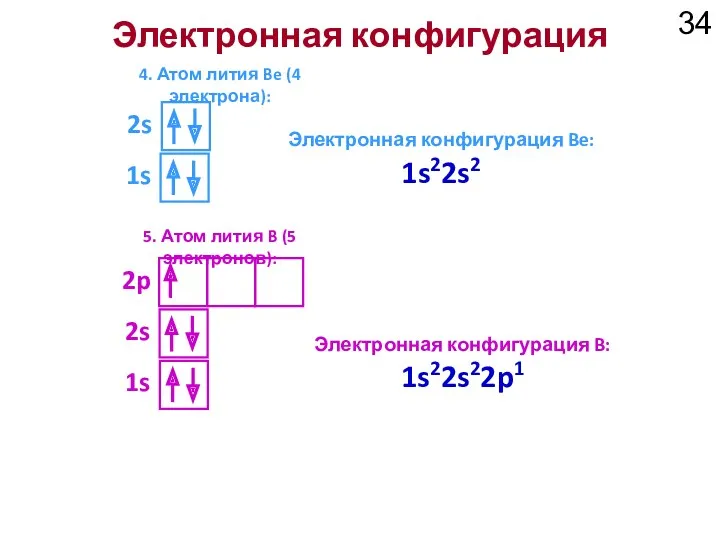
- 34. Электронная конфигурация 4. Атом лития Be (4 электрона): 1s Электронная конфигурация Be: 1s22s2 2s 5. Атом
- 35. Химические свойства определяются электронным строением внешнего электронного слоя атома. Электроны на внешнем уровне называются валентными.
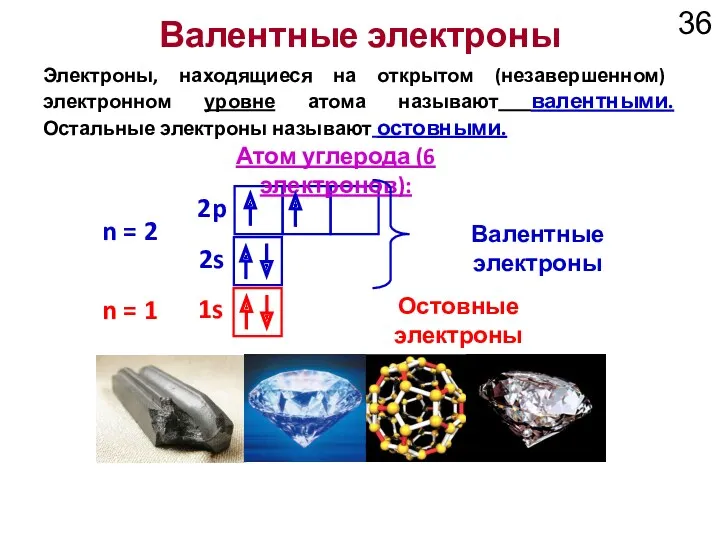
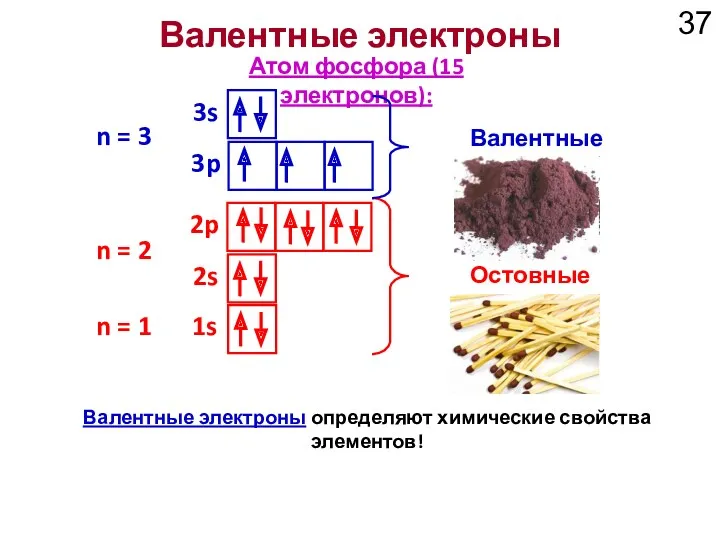
- 36. Валентные электроны Электроны, находящиеся на открытом (незавершенном) электронном уровне атома называют валентными. Остальные электроны называют остовными.
- 37. 1s 2s 2p Атом фосфора (15 электронов): n = 1 n = 2 Остовные электроны 3s
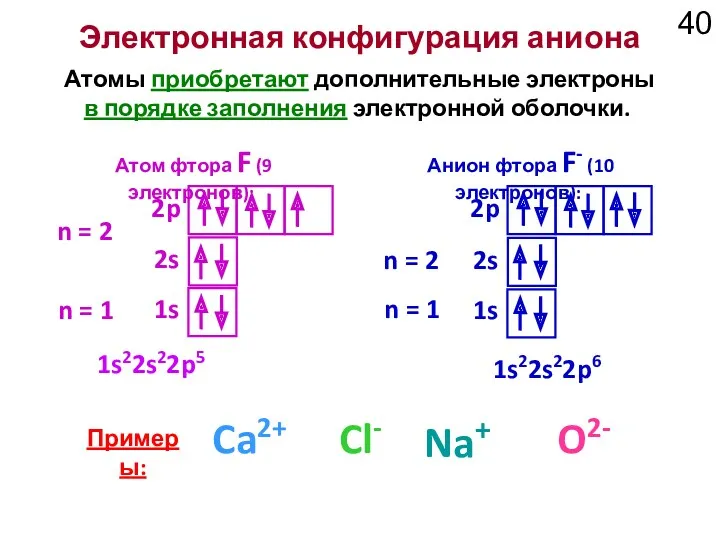
- 40. Электронная конфигурация аниона Атомы приобретают дополнительные электроны в порядке заполнения электронной оболочки. 1s 2s 2p n
- 41. Энергия выделяющаяся или поглощающаяся при присоединении электрона к атому называется сродство к электрону A + e
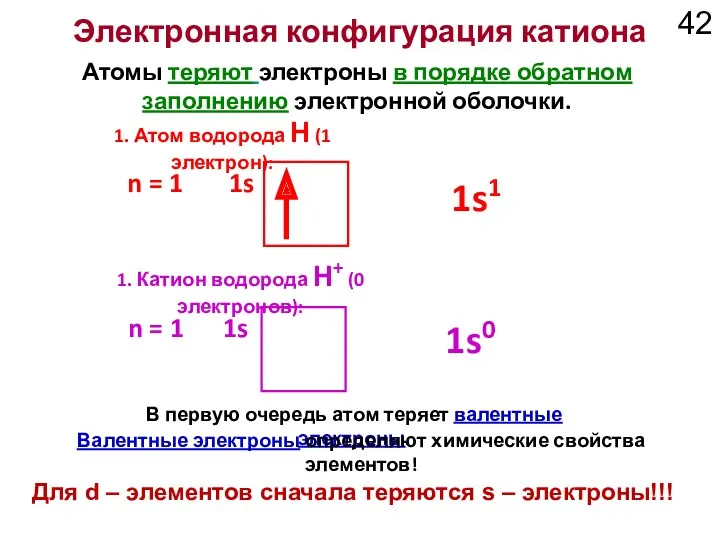
- 42. Электронная конфигурация катиона В первую очередь атом теряет валентные электроны. Атомы теряют электроны в порядке обратном
- 43. Fe – [Ar] 3d64s2 Fe2+ – [Ar]3d6 Энергия необходимая для отрыва электрона называется энергия ионизации. A
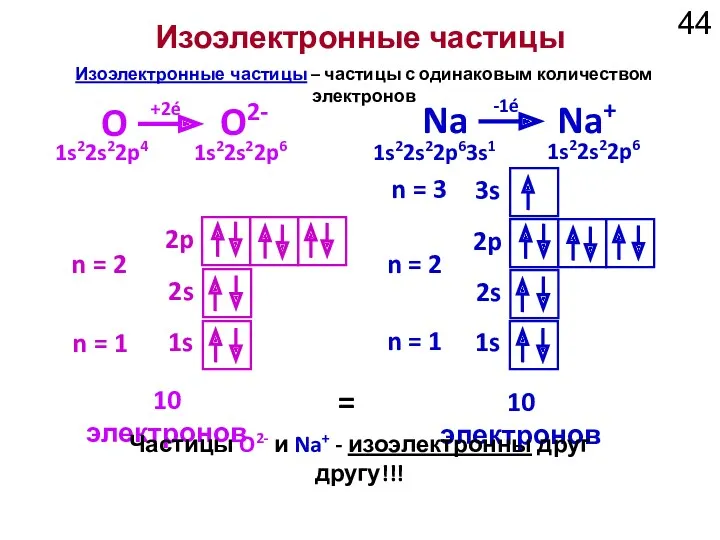
- 44. Изоэлектронные частицы 1s 2s 2p n = 1 n = 2 1s 2s 2p n =
- 46. Скачать презентацию
















![Fe – [Ar] 3d64s2 Fe2+ – [Ar]3d6 Энергия необходимая для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/363521/slide-42.jpg)
 Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Альдегіди. Номенклатура альдегідів
Альдегіди. Номенклатура альдегідів Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы Ионные уравнения реакций
Ионные уравнения реакций Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Степень окисления ОВР
Степень окисления ОВР Вещества и материалы. Классификация веществ. Реакции нейтрализации
Вещества и материалы. Классификация веществ. Реакции нейтрализации Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь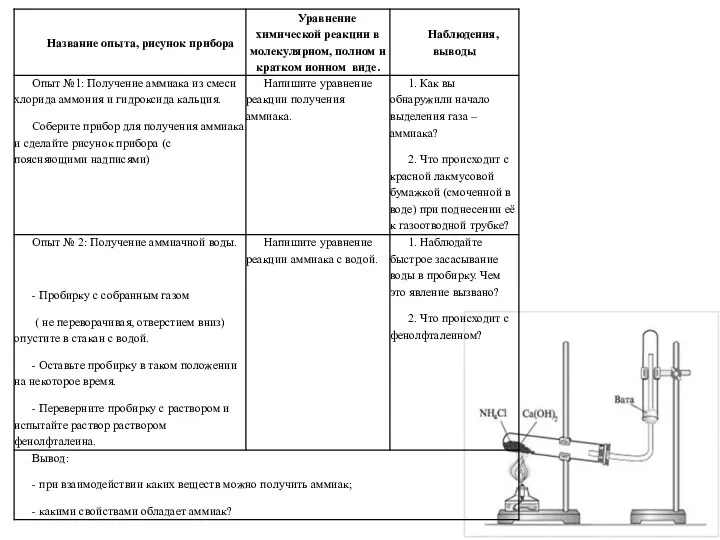 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Кислород как элемент
Кислород как элемент Соли аммония
Соли аммония Материаловедение и методы диагностики микро- и наноструктурных материалов
Материаловедение и методы диагностики микро- и наноструктурных материалов Растворы ВМС и их свойства
Растворы ВМС и их свойства Химические свойства основных оксидов
Химические свойства основных оксидов Горение топлива
Горение топлива Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Химическая картина мира
Химическая картина мира Карбоновые кислоты
Карбоновые кислоты Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Координационные соединения
Координационные соединения Формы нахождения минералов в природе
Формы нахождения минералов в природе Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43
Азотная кислота. Соли азотной кислоты. Получение и применение азотной кислоты. Урок 43