Содержание
- 3. Пожар в центре Грабаря
- 4. Возвращенные шедевры
- 5. Леонардо да Винчи. Тайная вечеря. Картина неизвестного художника. Джорджоне.Юдифь. И.И. Левитан. У омута. И.К.Айвазовский.Радуга.
- 6. Ионные уравнения реакций. Цель: Познакомиться с понятием ионные уравнения и рассмотреть случаи, при которых реакции ионного
- 7. ВОПРОСЫ Какие вещества называются электролитами? . Какие вещества называются неэлектролитами? Что называется ионом? Что называется электролитической
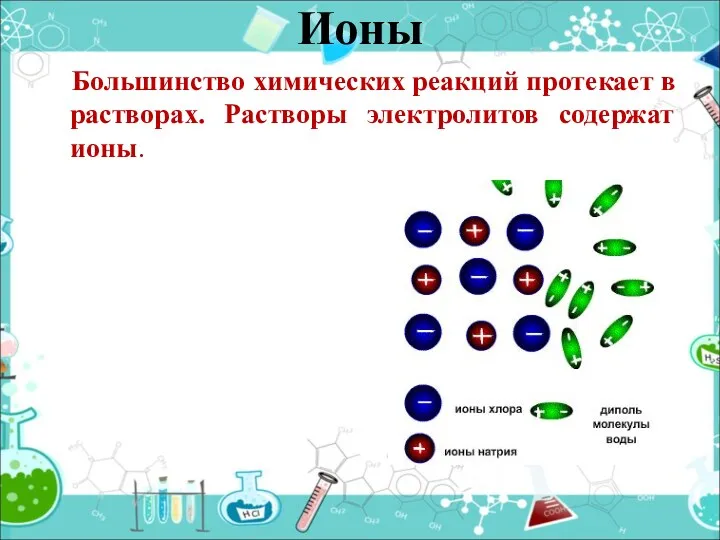
- 8. Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы. Ионы
- 9. НСl + AgNO3 → AgCl + НNO3
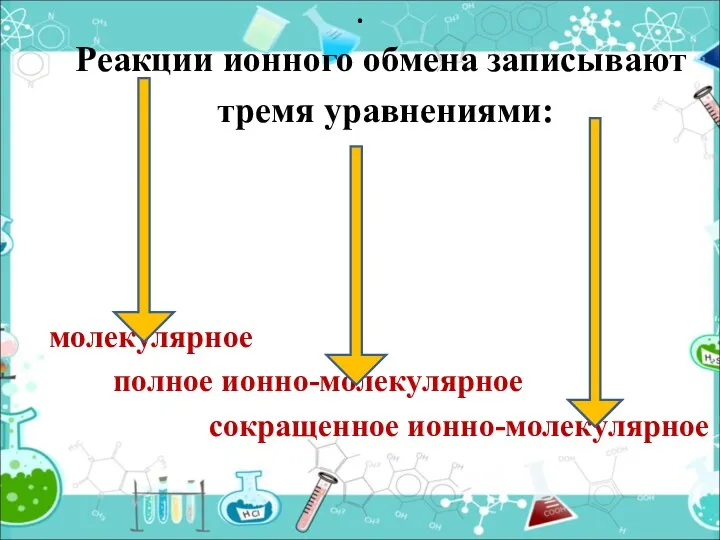
- 10. Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионно-молекулярное сокращенное ионно-молекулярное .
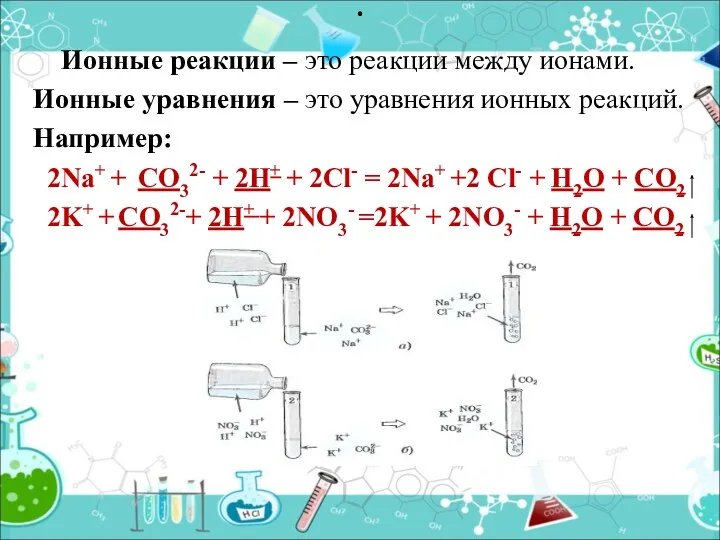
- 11. Ионные реакции – это реакции между ионами. Ионные уравнения – это уравнения ионных реакций. Например: 2Na+
- 12. Практическое исследование
- 13. Помните, что любое вещество может быть опасным, если обращаться с ним неправильно! Без указания учителя не
- 14. Никогда не пробуйте химические вещества на вкус!
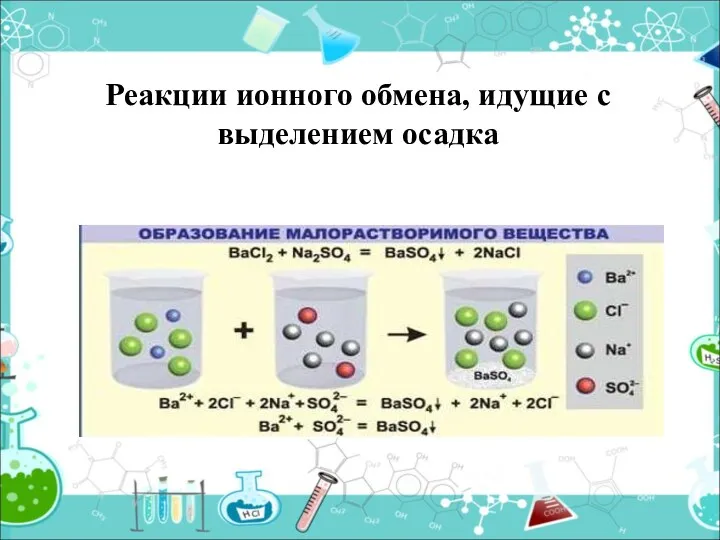
- 15. Реакции ионного обмена, идущие с выделением осадка
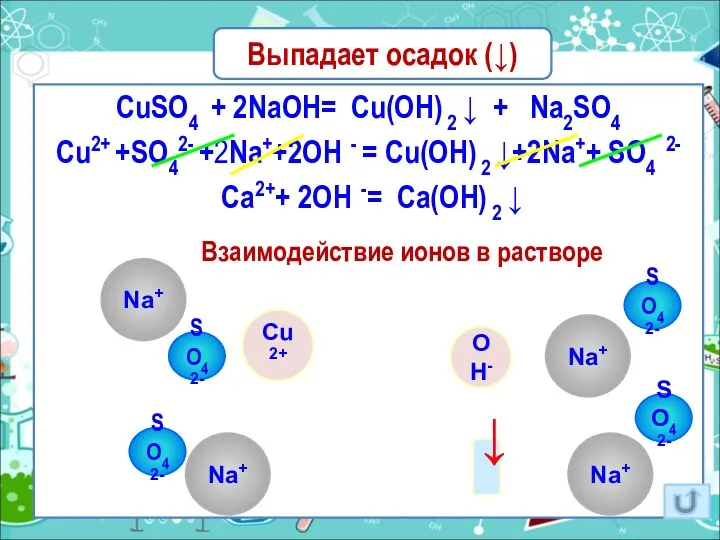
- 16. Выпадает осадок (↓) CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4 Cu2+ +SO42- +2Na++2OH - =
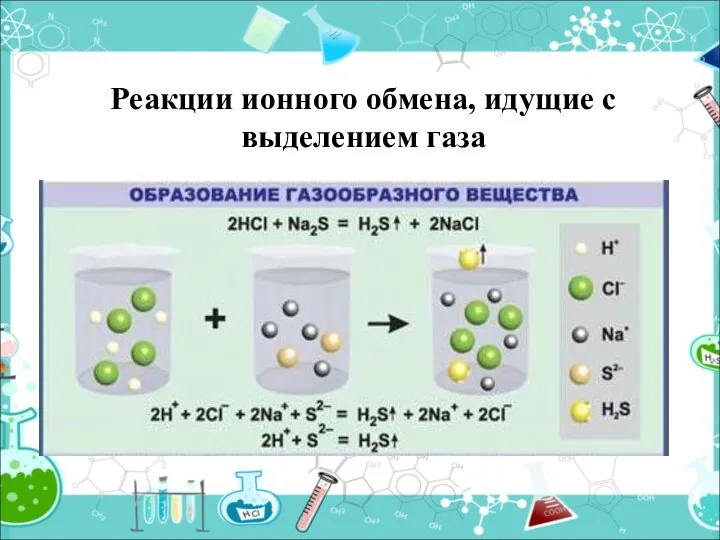
- 17. Реакции ионного обмена, идущие с выделением газа
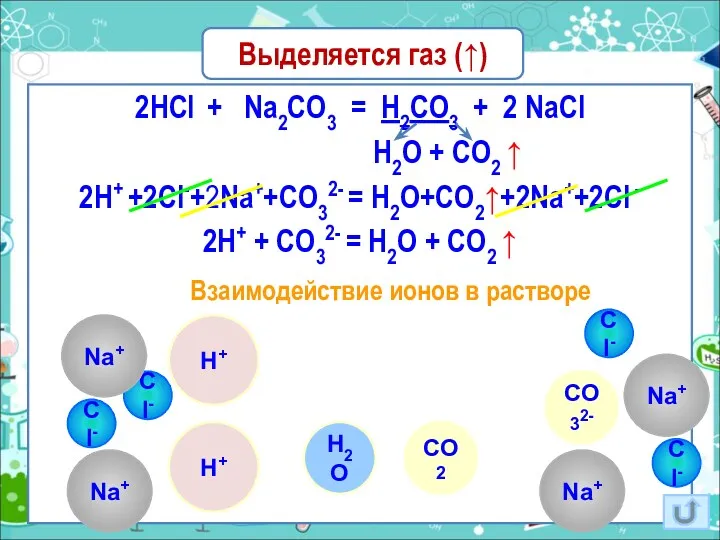
- 18. Выделяется газ (↑) 2HCl + Na2CO3 = H2CO3 + 2 NaCl H2O + CO2 ↑ 2H+
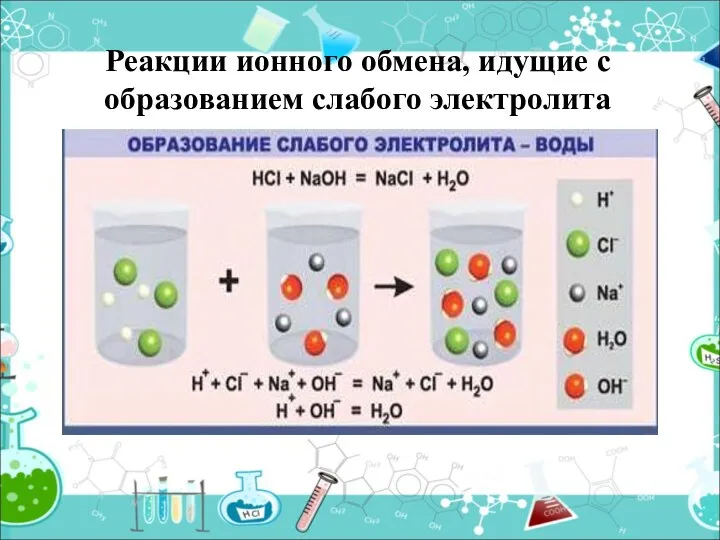
- 19. Реакции ионного обмена, идущие с образованием слабого электролита
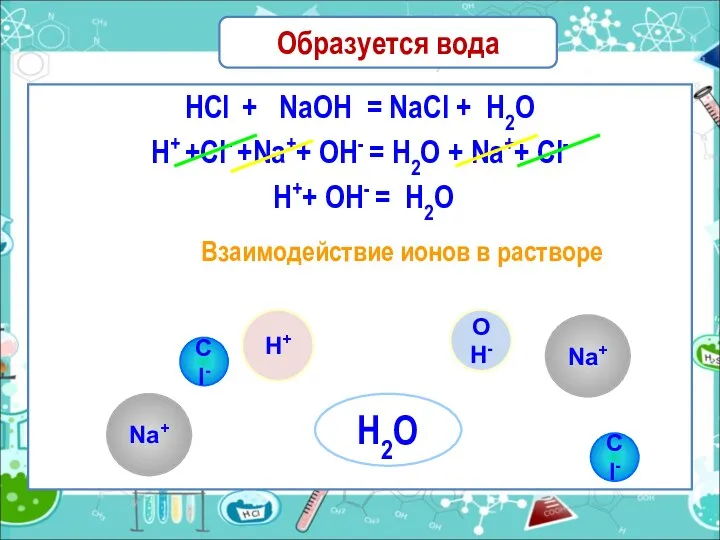
- 20. Образуется вода HCl + NaOH = NaCl + H2O H+ +Cl- +Na++ OH- = H2O +
- 21. Na2SO4 + KI Na+ SO42- K+ I- 1.Нет осадка 2.Не выделяется газ 3.Не образуется слабый электролит
- 22. В соответствии с правилом Бертолле ионные реакции протекают практически необратимо: I случай II случай III случай
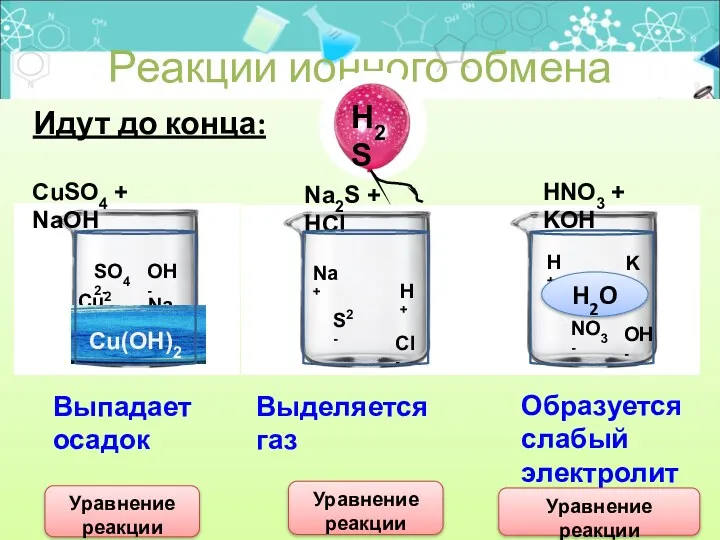
- 23. Идут до конца: Реакции ионного обмена CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+
- 24. Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия.
- 25. В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного
- 26. Применение ионитов В медицине: 1.Для увеличения сроков хранения крови. 2.Для производства, выделения и очистки антибиотиков. 3.Использование
- 27. Сокращенному ионному уравнению Bа2+ + SО42- BаSО4 соответствуют схемы уравнений химических реакций
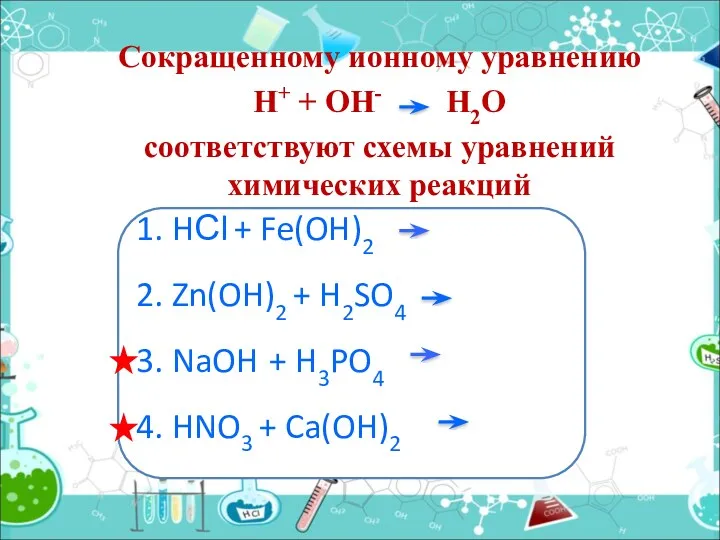
- 28. Сокращенному ионному уравнению Н+ + ОН- H2O соответствуют схемы уравнений химических реакций
- 29. Al2O3 + 6H+ = 2Al3+ + 6H2O 1.Al2O3 + 3CO2 = Al2(CO3)3 2.Al(NO3)3 + 3KOH =
- 30. Установи соответствие между продуктами реакций ионного обмена и схемами реакций газ Ca(OH)2 + НСl => NaOH
- 31. 1.SO42-и H+ ; Ag+ и Cl- 2.Cl- и Fe 2+ ; Fe2+ и OH- 3.OH- и
- 33. Домашнее задание § 37, упр. 4, 5. В сточных водах гальванического цеха химического завода обнаружены катионы
- 35. Скачать презентацию



















 Хімічні властивості алкенів
Хімічні властивості алкенів Исследование снежного покрова
Исследование снежного покрова Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Контроль результатов обучения химии
Контроль результатов обучения химии Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Электронные конфигурации атомов
Электронные конфигурации атомов Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Значение периодического закона
Значение периодического закона Количество вещества. Молярная масса
Количество вещества. Молярная масса МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ
МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ Electron Structure
Electron Structure Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Кремний и его соединения. 9 класс
Кремний и его соединения. 9 класс Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Аминокислоты. Белки
Аминокислоты. Белки Химический состав нефтей. Циклические соединения
Химический состав нефтей. Циклические соединения Основания
Основания Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Получение и применение спиртов
Получение и применение спиртов Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие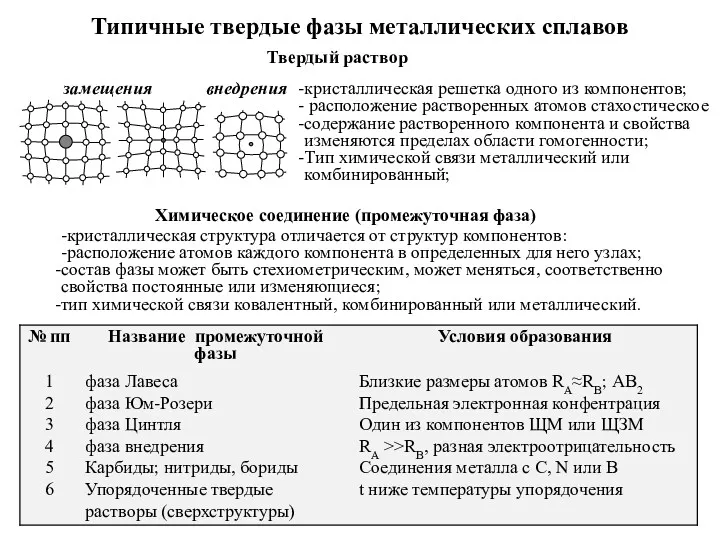 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Электродные системы
Электродные системы