Содержание
- 2. ПРОВЕРКА ЗНАНИЙ
- 3. 1.Определите, о каком веществе идёт речь I вариант Бесцветный газ, плохо растворим в воде, легко соединяется
- 4. I вариант NO – оксид азота (II) II вариант NH3 - аммиак
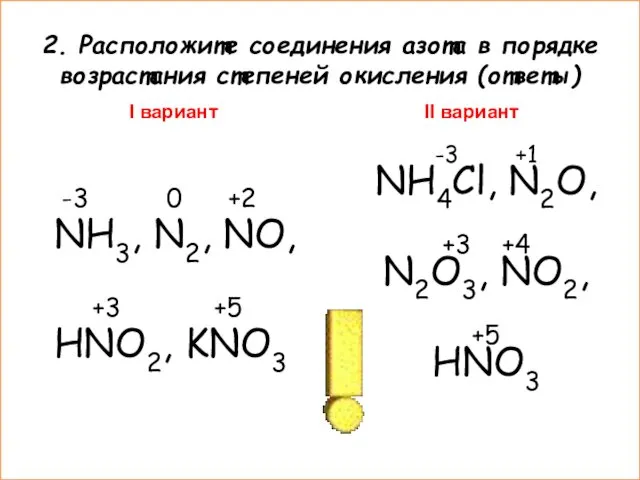
- 5. 2. Расположите соединения азота в порядке возрастания степеней окисления I вариант N2, NH3, KNO3, NO, HNO2
- 6. 2. Расположите соединения азота в порядке возрастания степеней окисления (ответы) I вариант -3 0 +2 NH3,
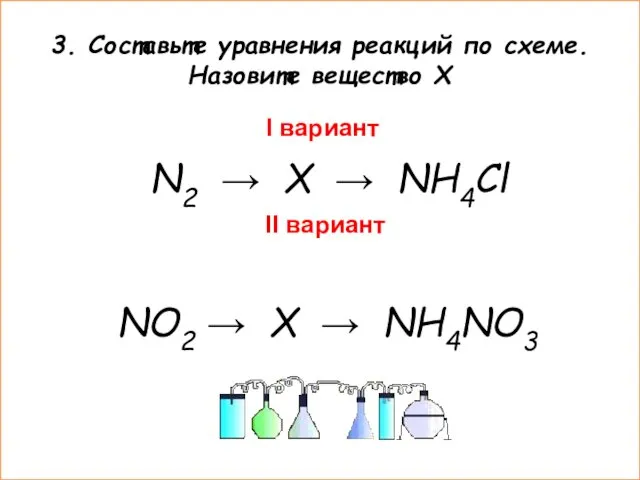
- 7. 3. Составьте уравнения реакций по схеме. Назовите вещество Х I вариант N2 → X → NH4Cl
- 8. 3. Составьте уравнения реакций по схеме. Назовите вещество Х (ответы) I вариант X – NH3 (аммиак)
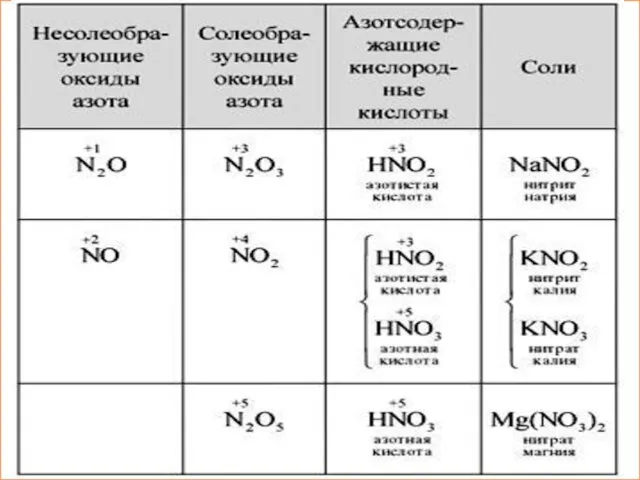
- 9. Кислородные соединения азота. Азотная кислота План изучения: I. Оксиды азота. Физические свойства азотной кислоты; II. Характеристика
- 11. I. Физические свойства азотной кислоты Агрегатное состояние – жидкость; Цвет – отсутствует; Запах – едкий, кислотный;
- 12. II. Характеристика HNO3 По основности: одноосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде:
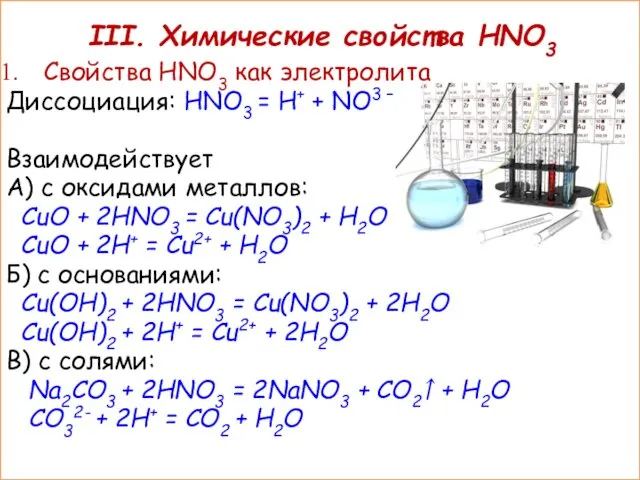
- 13. III. Химические свойства HNO3 Свойства HNO3 как электролита Диссоциация: HNO3 = H+ + NO3 – Взаимодействует
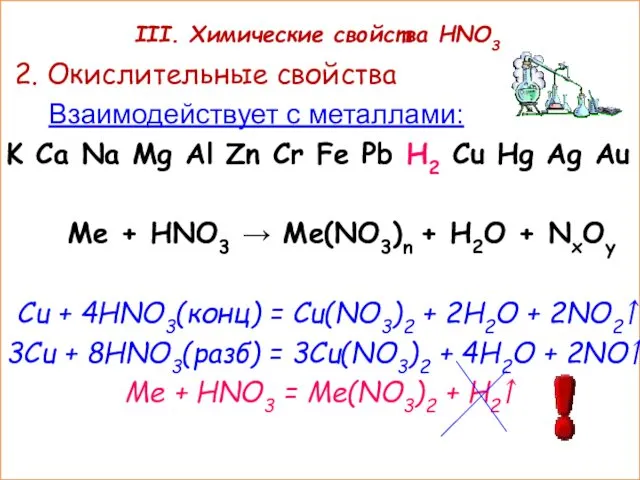
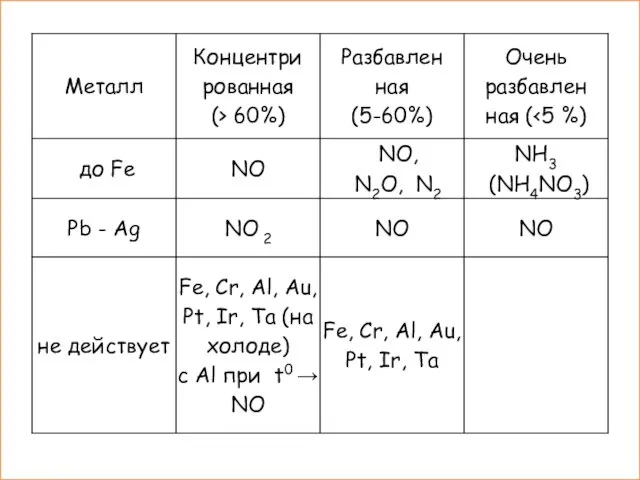
- 14. III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с металлами: K Ca Na Mg Al Zn
- 15. III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с неметаллами: (S, P, C) C C +
- 17. IV. Применение азотной кислоты HNO3
- 18. Вопросы на закрепление I. Назовите вещества, с которыми может реагировать азотная кислота как электролит: SO2 H2
- 20. Скачать презентацию









 Явления, происходящие с веществами
Явления, происходящие с веществами Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов
Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов Степень окисления
Степень окисления Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Застосування неметалів
Застосування неметалів Органическая химия. Ацетилен
Органическая химия. Ацетилен Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Растворы. Лекция 1
Растворы. Лекция 1 Композиционные материалы
Композиционные материалы Химия. ОГЭ
Химия. ОГЭ Кристаллические решетки
Кристаллические решетки Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Изомерия. Виды изомерии
Изомерия. Виды изомерии Понятие Химический элемент
Понятие Химический элемент Кристаллография и основы кристаллохимии
Кристаллография и основы кристаллохимии Гетероциклические соединения
Гетероциклические соединения Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Дисперсные системы
Дисперсные системы Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Крохмаль і целюлоза. Полімерна будова, властивості, застосування
Крохмаль і целюлоза. Полімерна будова, властивості, застосування Кремний и его соединения
Кремний и его соединения Способы разделения смесей
Способы разделения смесей