2 уровень
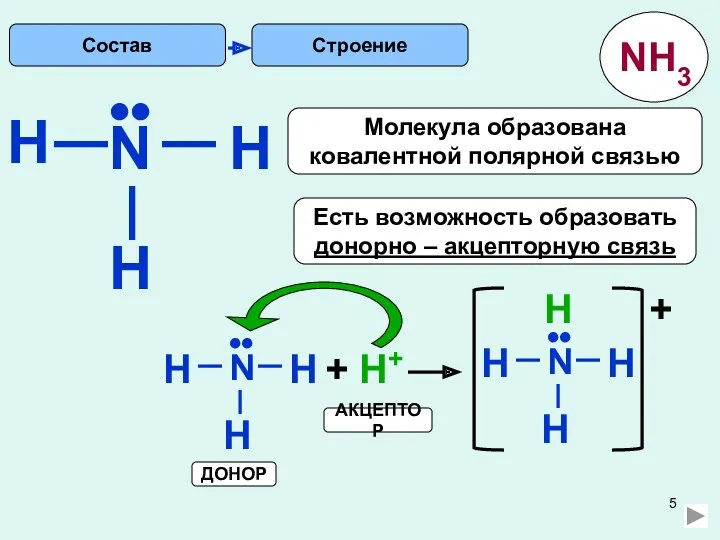
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну Б. Две В.
Три Г. Пять
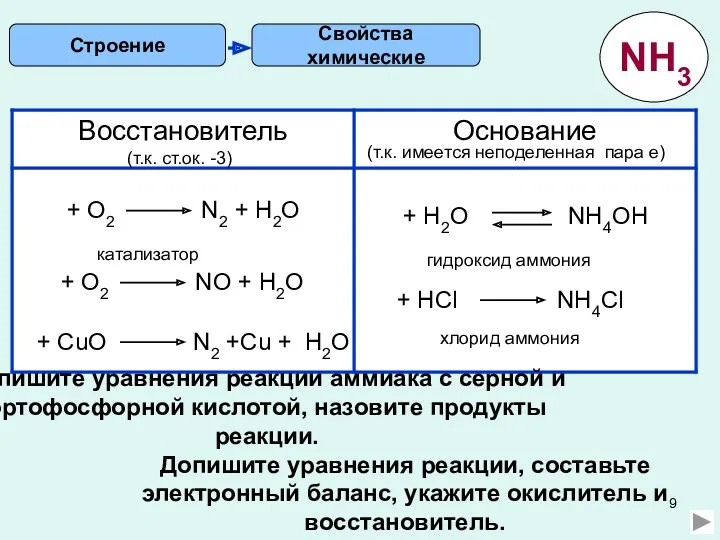
2) Какое вещество является восстановителем в реакции
NH3 + O2 ? N2 + H2O
А. Аммиак Б. Кислород В. Азот Г. Вода
3) Аммиак не взаимодействует с:
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
4) Установите соответствие:
Свойства азота Химические уравнения реакций
1. Реакции, связанные с изменением А. NH3 + H2O ↔NH4OH
степени окисления азота. Б. 2NH3↔N2 + 3H2
2. Реакции, связанные с образованием В. 4NH3 + 3O2 = 2N2 +6H2O
ковалентной связи по донорно-акцептор - Г. NH3 + HCl = NH4Cl
ному механизму.
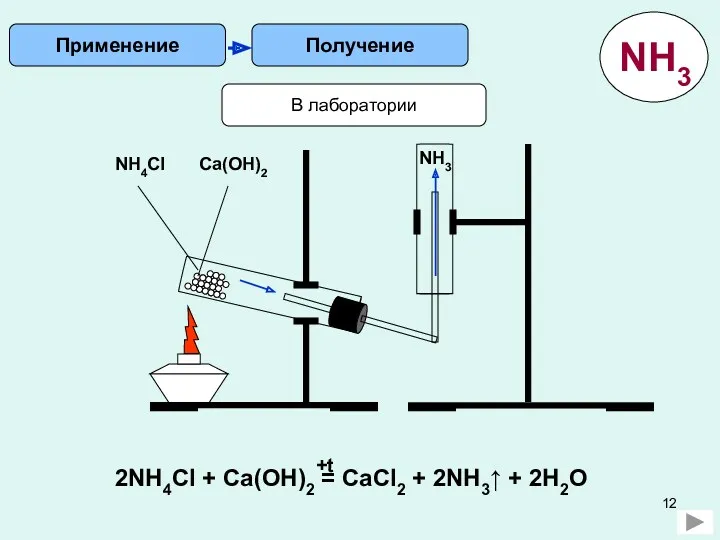
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO3.
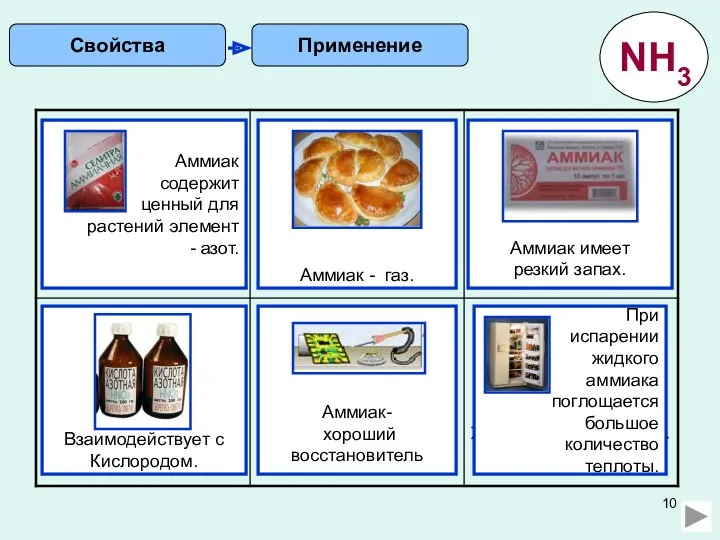
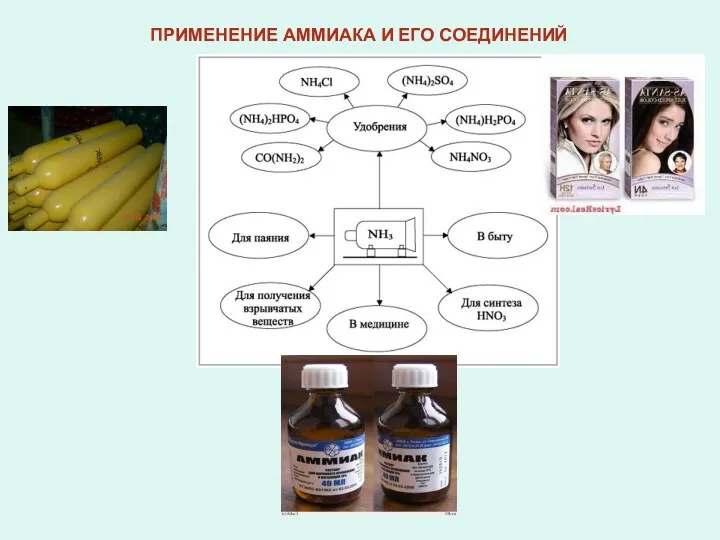
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.







 Основания. 8 класс
Основания. 8 класс Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Поняття про побутові хімікати
Поняття про побутові хімікати Цинковое покрытие
Цинковое покрытие Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Группы сходных химических элементов
Группы сходных химических элементов Кислород
Кислород Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Свойства фосфора
Свойства фосфора Бытовая химическая грамотность
Бытовая химическая грамотность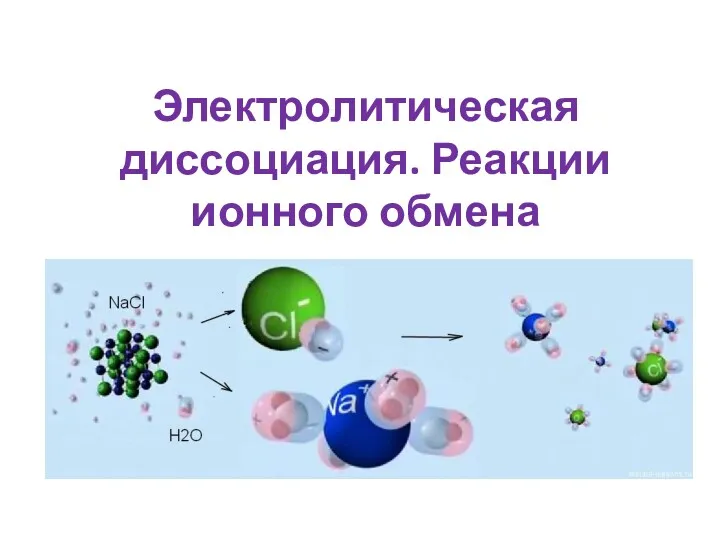 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Алмазы. Бриллианты
Алмазы. Бриллианты Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Арены. Бензол
Арены. Бензол Камни и Скорпион
Камни и Скорпион Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Reactors for catalytic alkylation
Reactors for catalytic alkylation Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Тяжёлая вода
Тяжёлая вода Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Чистые вещества и смеси
Чистые вещества и смеси Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24)