Содержание
- 2. Положение кислорода в П.С.Х.Э. 2 период, Родоначальник 6-А группы «Халькогены» - рождающие руды (O,S,Se,Te,Po) Строение атома
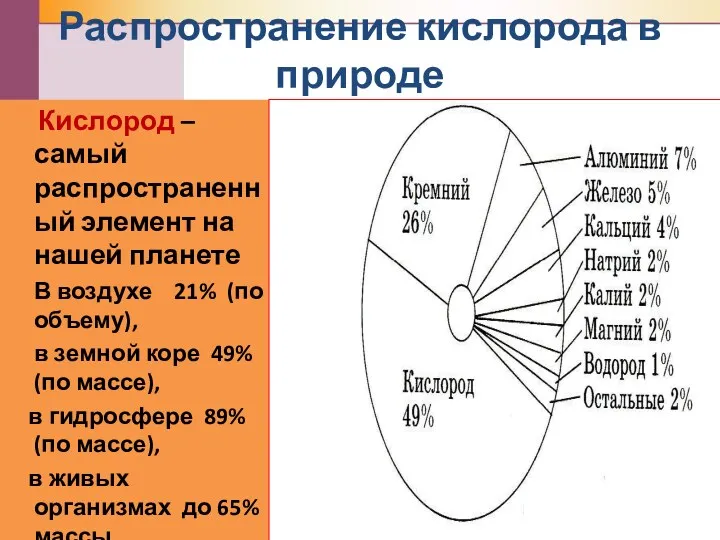
- 3. Распространение кислорода в природе Кислород – самый распространенный элемент на нашей планете В воздухе 21% (по
- 4. Физические свойства Агрегатное состояние - газ при обычных условиях. При очень низких температурах (-183°С) переходит в
- 5. Кислород входит в состав воды, которая составляет большую часть массы живых организмов и является внутренней средой
- 6. Химические свойства Взаимодействие веществ с кислородом называется окислением. Реакции окисления, сопровождающиеся выделением теплоты и света, называются
- 7. Реакции с металлами В результате реакции образуется оксид этого металла. Например, алюминий окисляется кислородом согласно уравнению:
- 8. Реакции с неметаллами Образуется оксид неметалла Горение фосфора с образованием оксида фосфора (V): t° 4Р +
- 9. Горение серы в кислороде с образованием сернистого газа SO2: t° S + O2 → SO2 Горение
- 10. Реакции со сложными веществами В этом случае образуются оксиды элементов, из которых состоит молекула сложного вещества.
- 11. Промышленный способ (перегонка жидкого воздуха) Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2KClO3 –t°;MnO2→ 2KCl + 3O2↑
- 12. Разложение перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 + O2↑ Реакция идёт при нагревании
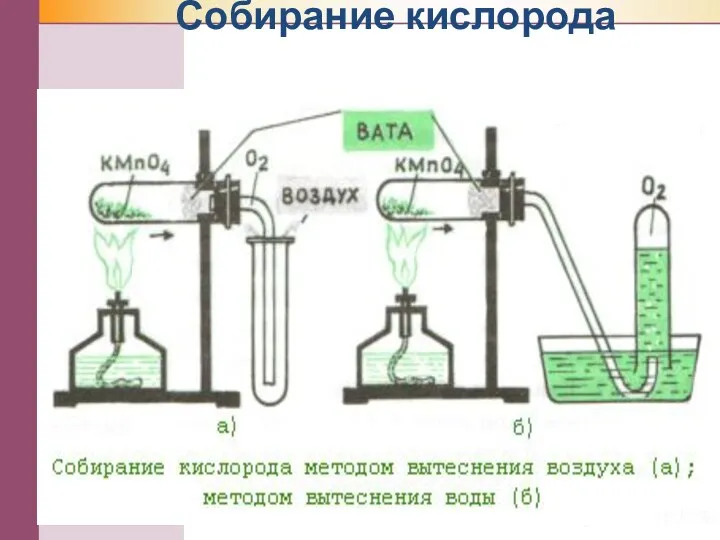
- 13. Собирание кислорода
- 14. Находит широкое применение в медицине и промышленности При высотных полётах лётчиков снабжают специальными приборами с кислородом
- 15. Открытие кислорода К. Шееле (1742-1786) Дж. Пристли (1733-1804) Эти два великих химика независимо друг от друга
- 16. Повторив опыты Пристли, Лавуазье заключил, что атмосферный воздух состоит из смеси «жизненного» (кислород) и «удушливого» (азот)
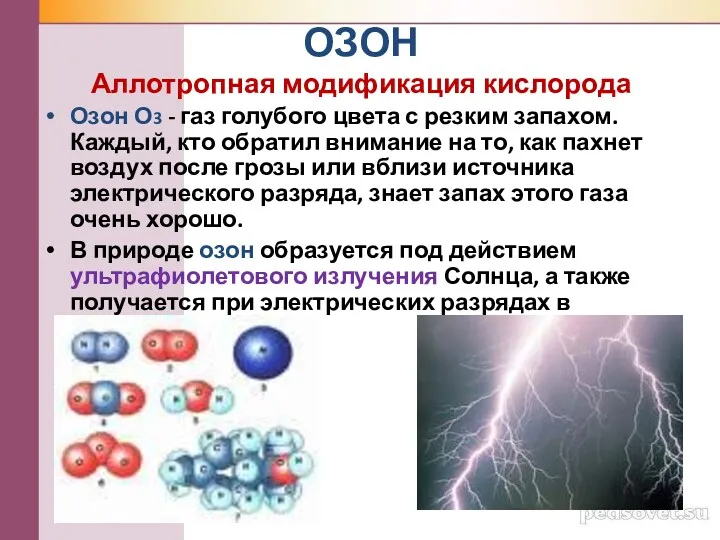
- 17. ОЗОН Аллотропная модификация кислорода Озон О3 - газ голубого цвета с резким запахом. Каждый, кто обратил
- 18. Озон - очень сильный окислитель, поэтому его используют при обеззараживании питьевой воды. При контакте с большинством
- 20. Приложение 1 «Вопросник к теме «Кислород» Назовите восьмой элемент «Периодической системы химических элементов Д.И.Менделеева» Кем и
- 21. Приложение 1 «Вопросник к теме «Кислород» ( продолжение) 12. Как кислород получают в лаборатории? 13. Как
- 23. Скачать презентацию

















 Спирты. Классификация спиртов
Спирты. Классификация спиртов Серная кислота. 9 класс
Серная кислота. 9 класс Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Воздух и его состав. Урок химии. 8 класс
Воздух и его состав. Урок химии. 8 класс Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Химические реакторы
Химические реакторы Жидкие кристаллы
Жидкие кристаллы Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Формы минералов и их агрегатов
Формы минералов и их агрегатов Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Хімічні сполуки у побуті
Хімічні сполуки у побуті Synthesis of Paclitaxel
Synthesis of Paclitaxel Дизельное топливо. Требования, предъявляемые к дизельным топливам
Дизельное топливо. Требования, предъявляемые к дизельным топливам Кислоты, их классификация и свойства в свете ТЭД
Кислоты, их классификация и свойства в свете ТЭД Растворение как физико-химический процесс
Растворение как физико-химический процесс Типы химических реакций
Типы химических реакций Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Эластомеры (резины)
Эластомеры (резины) Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Сера и её соединения
Сера и её соединения Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Водород
Водород