Содержание
- 2. Fe3+ + e ⇔ Fe2+ Окислительно-восстановительные электроды состоят из инертного металлического проводника, опущенного в раствор, содержащий
- 3. При увеличении рН электролита соль Fe3+ гидролизуется (при рН ≥ 3 образуется Fe(OH)3) и активность Fe3+
- 4. MnO4- + 8H+ + 5e ⇔ Mn2+ + 4H2O В сложных системах происходит не только изменение
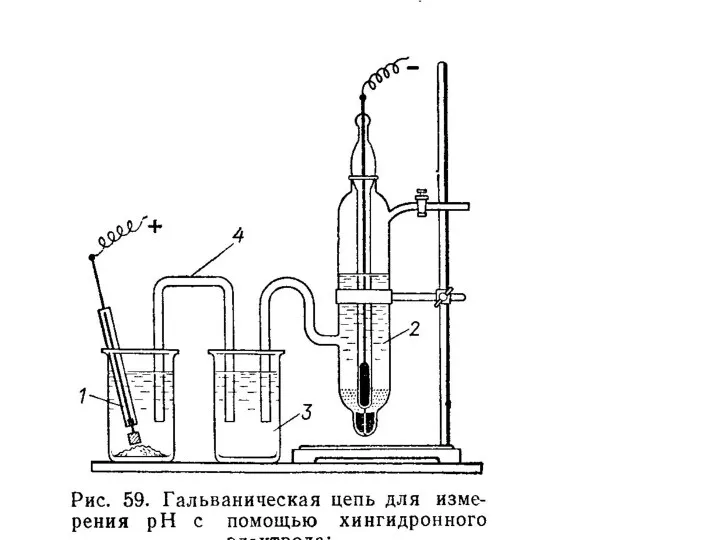
- 5. Инертный электрод (Au или Pt), помещенный в раствор, содержащий хинон, гидрохинон и ионы водорода, принимает потенциал,
- 7. Правило Лютера. Систему, состоящую из металла М в растворе, содержащем ионы этого металла в двух степенях
- 8. Ионизация М до может проходить либо ступенчато – через промежуточную степень окисления, либо непосредственно – до
- 9. Правило Лютера используют, когда экспериментальное определение одного из стандартных потенциалов затруднено или невозможно. Если известны значения
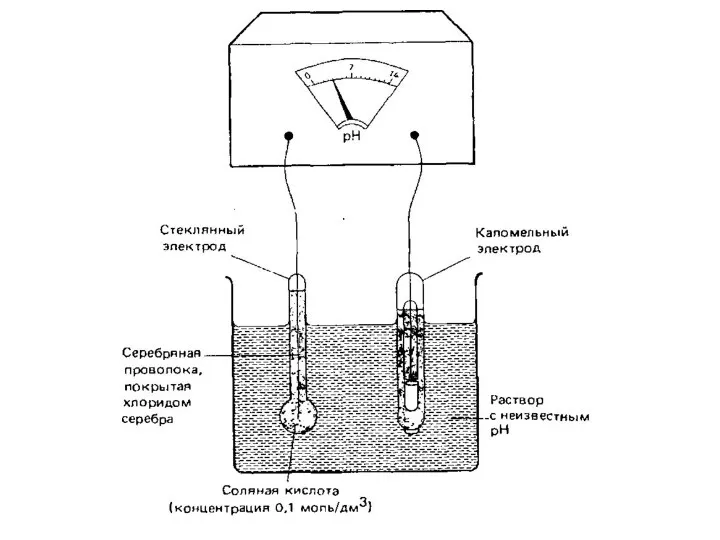
- 10. Ионселективные электроды отличаются от рассмотренных выше электродов тем, что на них идет обмен не электронами, а
- 11. Фактически в реакцию обмена вовлекаются не только ионы водорода, но и ионы щелочного металла стекла: М+ст.
- 12. Таким образом, в сильно щелочных растворах потенциал электрода зависит от активности ионов металла, стеклянный электрод приобретает
- 16. Для приготовления стеклянных электродов с водородной функцией одним из лучших является стекло “Корнинг 015”, его состав
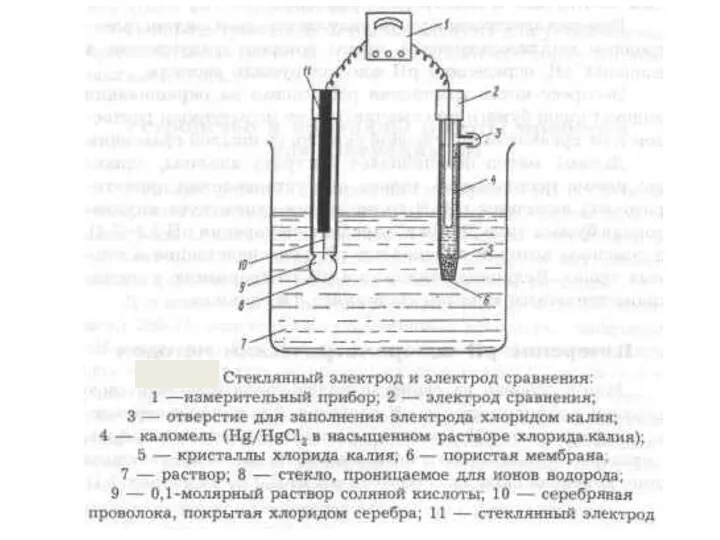
- 17. Ag⏐AgCl│HCl│стекло│HCl│AgCl⏐Ag E1 E3 E4 E2 Стеклянные электроды готовятся из расплавленного стекла, химический состав стекол на внутренней
- 18. Ионселективные электроды + + + + + + + + + + _ _ _ _
- 20. Скачать презентацию














 Разнообразие неметаллов
Разнообразие неметаллов Подгруппа углерода
Подгруппа углерода Метод МО
Метод МО Химия и производство
Химия и производство Реакции подлинности лекарственных веществ
Реакции подлинности лекарственных веществ Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Кремний и его соединения
Кремний и его соединения Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химическая кинетика и катализ
Химическая кинетика и катализ Происхождение химических элементов
Происхождение химических элементов Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5) Липиды. Составные части липидов
Липиды. Составные части липидов Chemical Equilibrium. Topic 3.3
Chemical Equilibrium. Topic 3.3 Дефекты в твердых телах
Дефекты в твердых телах Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Циклоалканы
Циклоалканы Пиролиз нефтяного сырья
Пиролиз нефтяного сырья Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Симметрия в химии. Кристаллы
Симметрия в химии. Кристаллы Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция АЛЮМИНИЙ
АЛЮМИНИЙ