Содержание
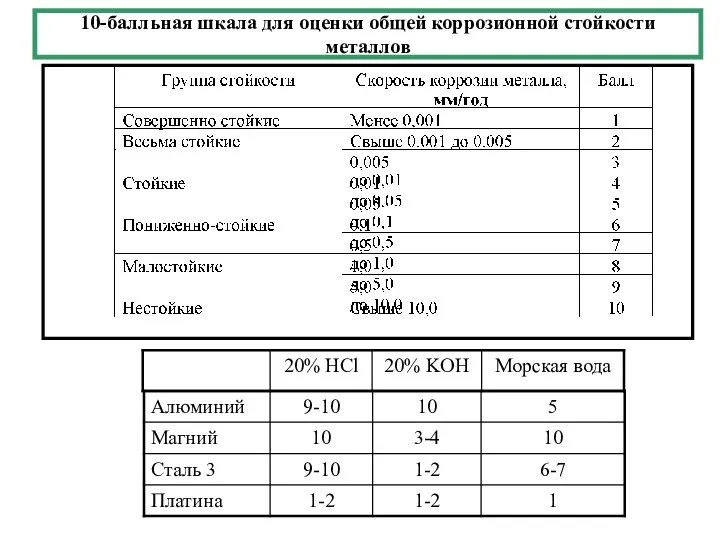
- 2. 10-балльная шкала для оценки общей коррозионной стойкости металлов
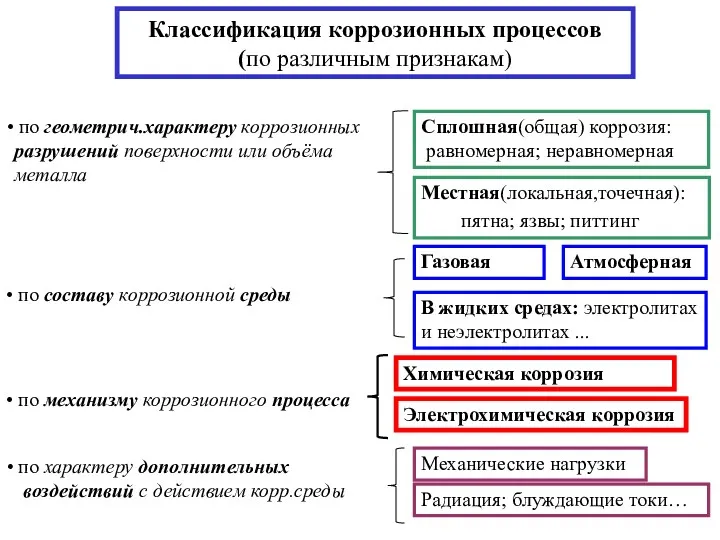
- 3. Классификация коррозионных процессов (по различным признакам)
- 4. 8.1 Химическая коррозия Гетерогенная окислительно-восстановительная реакция (между Ме и окислителем). Окисление металла и восстановление окислителя окружающей
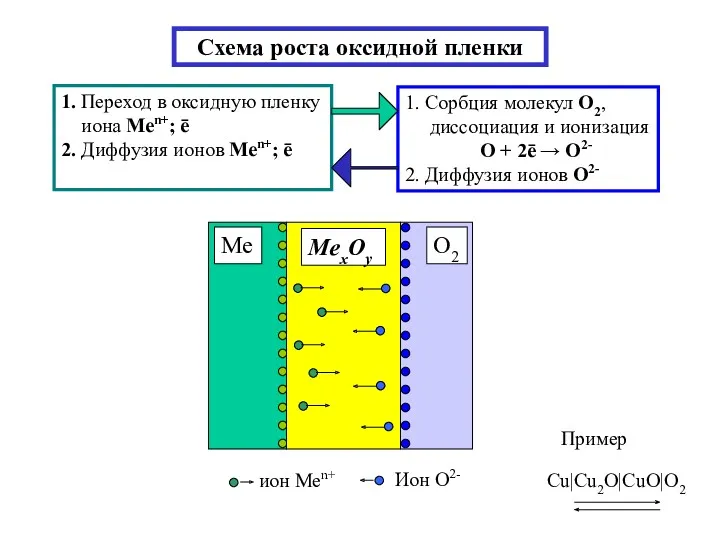
- 5. Схема роста оксидной пленки 1. Переход в оксидную пленку иона Меn+; ē 2. Диффузия ионов Меn+;
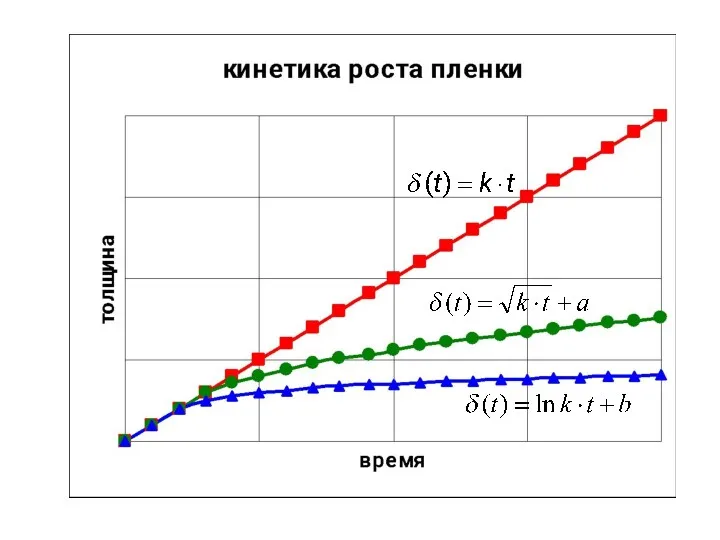
- 6. Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой) Кинет. уравн. роста оксидной пленки( xMe
- 7. Кинетика роста оксидной пленки 2. Лимитирующая стадия диффузия (наличие сплошной оксидной плёнки). Скорость коррозии (роста пленки)
- 9. Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки) 1. Защитные свойства пленок – определяет
- 10. 8.2 Водородная коррозия (охрупчивание) Уменьшение пластичности металла (охрупчивание) в газовой среде содержащий водород (Н2) из-за растворения
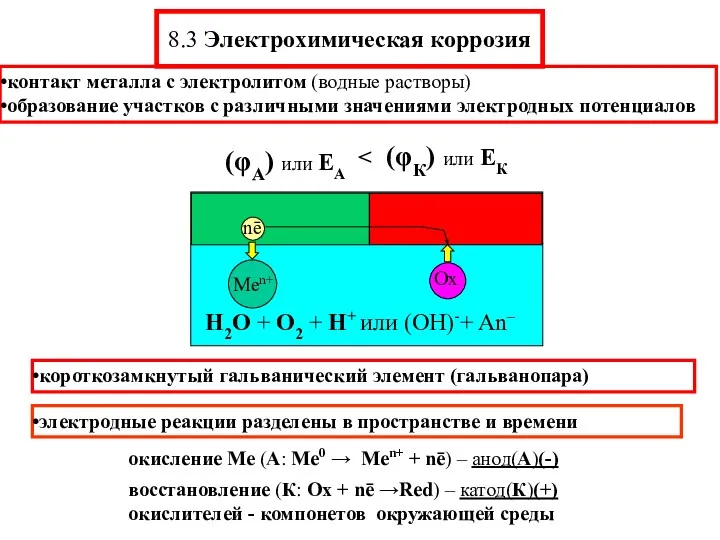
- 11. 8.3 Электрохимическая коррозия контакт металла с электролитом (водные растворы) образование участков с различными значениями электродных потенциалов
- 12. Электродные реакции анодные – окисления Ме, катодные –восстановления (деполяризации) А: Me0 → Men+ + nē Деполяризация
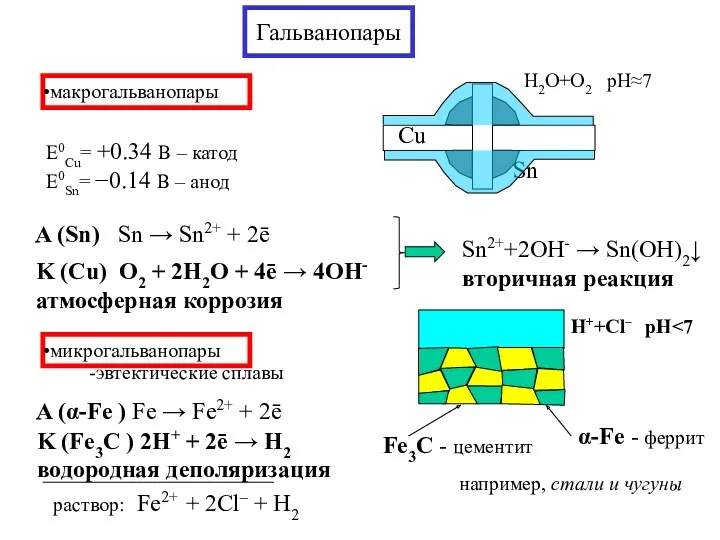
- 13. Гальванопары макрогальванопары E0Cu= +0.34 В – катод E0Sn= −0.14 В – анод микрогальванопары
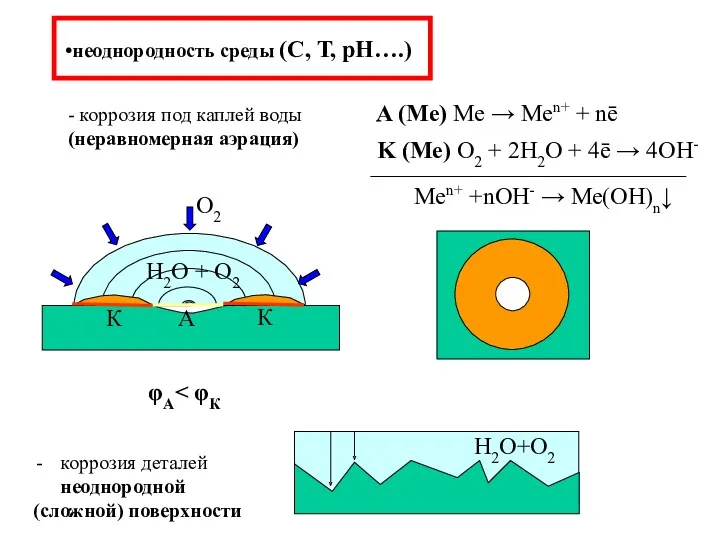
- 14. неоднородность среды (С, Т, рН….) - коррозия под каплей воды (неравномерная аэрация) коррозия деталей неоднородной (сложной)
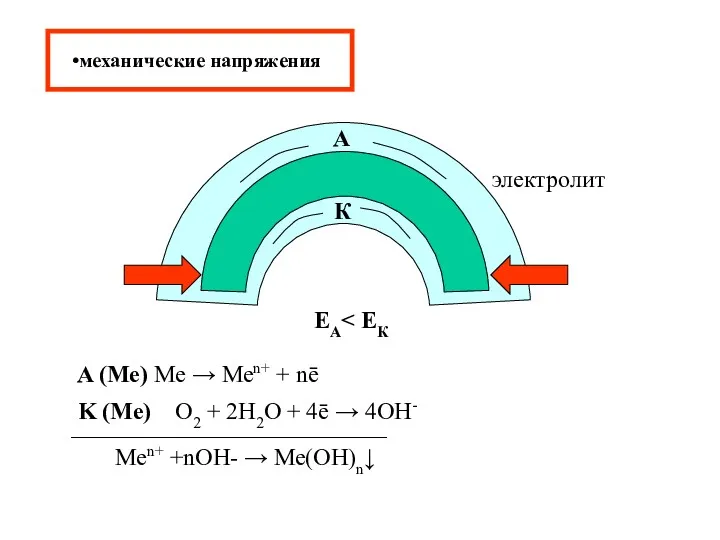
- 15. механические напряжения
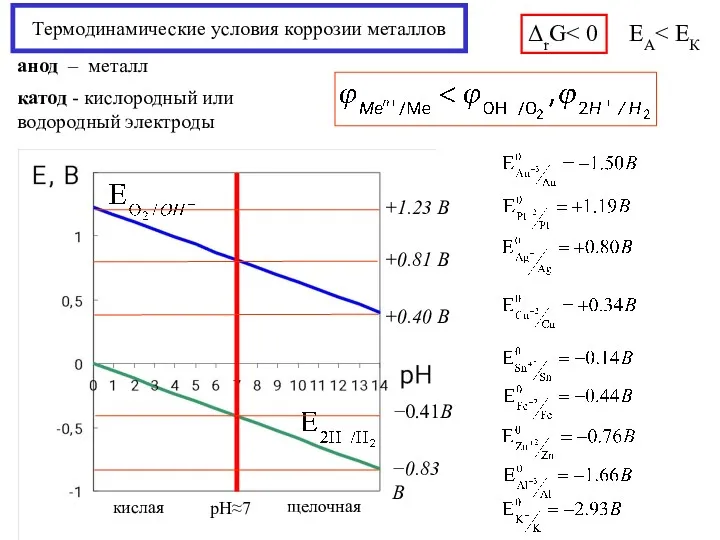
- 16. Термодинамические условия коррозии металлов ЕА анод – металл катод - кислородный или водородный электроды ΔrG
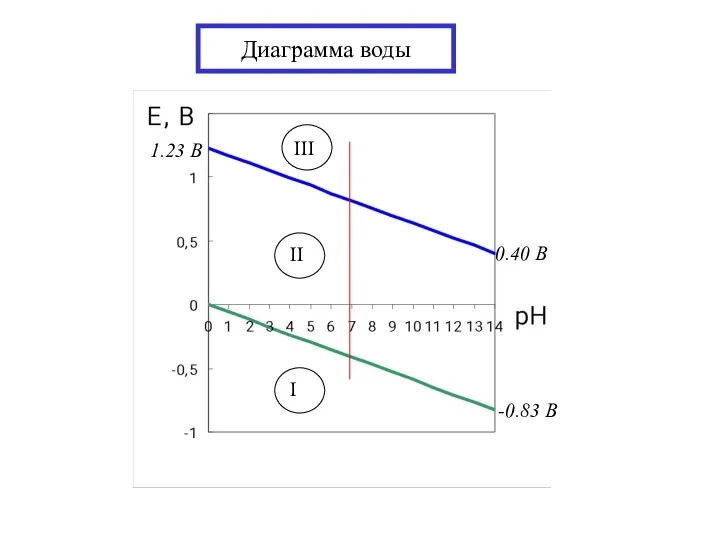
- 17. Диаграмма воды
- 19. Скачать презентацию






 Неметаллические материалы
Неметаллические материалы Электролитическая диссоциация
Электролитическая диссоциация Основные характеристики клеев
Основные характеристики клеев Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Полимеры. Мономер
Полимеры. Мономер Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Хлорид натрия
Хлорид натрия Органическая химия. Жиры
Органическая химия. Жиры Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Продукция UNIL
Продукция UNIL Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химический элемент кремний
Химический элемент кремний Магматические горные породы
Магматические горные породы Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Простые вещества
Простые вещества Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Незвичайна вода
Незвичайна вода Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Алкадиены
Алкадиены Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Коррозия металлов
Коррозия металлов ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)