Содержание
- 2. Назви етерів
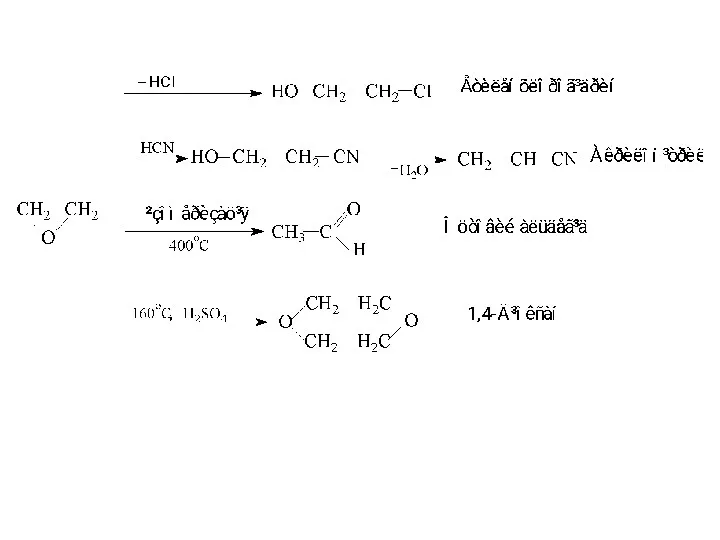
- 3. МЕТОДИ ОДЕРЖАННЯ Міжмолекулярна дегідратація спиртів у присутностi мінеральних кислот Дана реакція є алкілуванням одного спирту іншим.
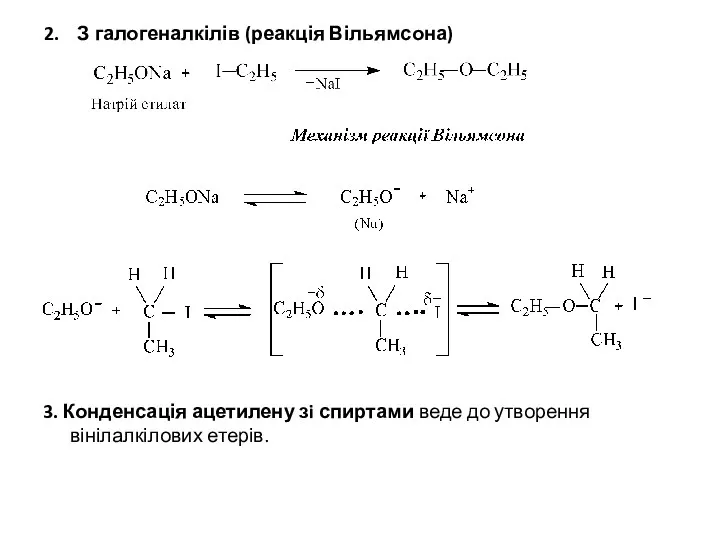
- 4. 2. З галогеналкілів (реакція Вільямсона) 3. Конденсація ацетилену зi спиртами веде до утворення вінілалкілових етерів.
- 5. ФІЗИЧНІ ВЛАСТИВОСТІ У етерів відсутнi водневi зв’язки, тому вони не розчиняються у водi i мають відносно
- 6. 1. Утворення оксонієвих сполук (оксонієвих солей) У присутностi сильних кислот утворюються протонованi етери (оксонієвi солi або
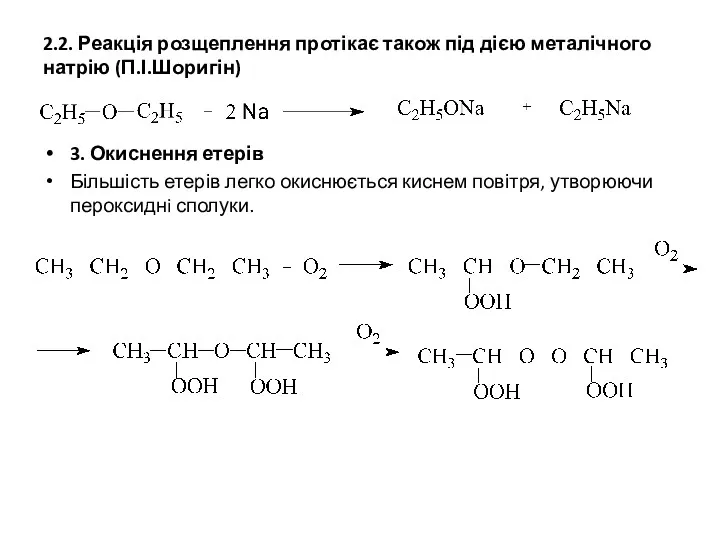
- 7. 2.2. Реакція розщеплення протікає також під дією металічного натрію (П.І.Шоригін) 3. Окиснення етерів Більшість етерів легко
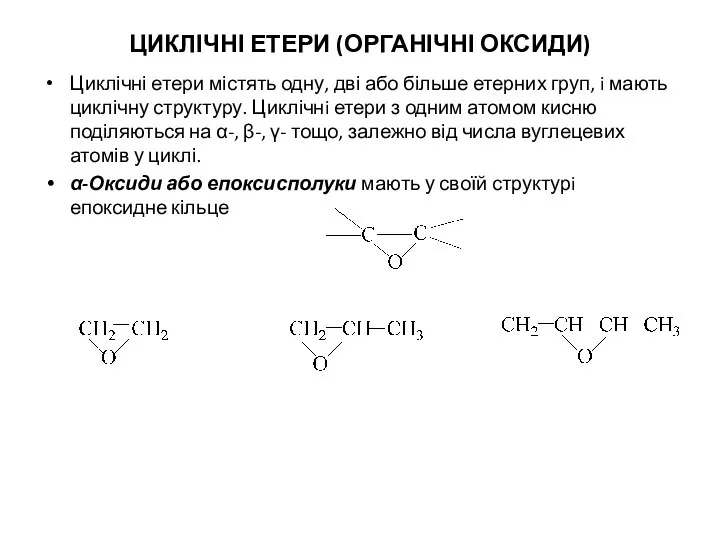
- 8. ЦИКЛІЧНІ ЕТЕРИ (ОРГАНІЧНІ ОКСИДИ) Циклічні етери містять одну, дві або більше етерних груп, i мають циклічну
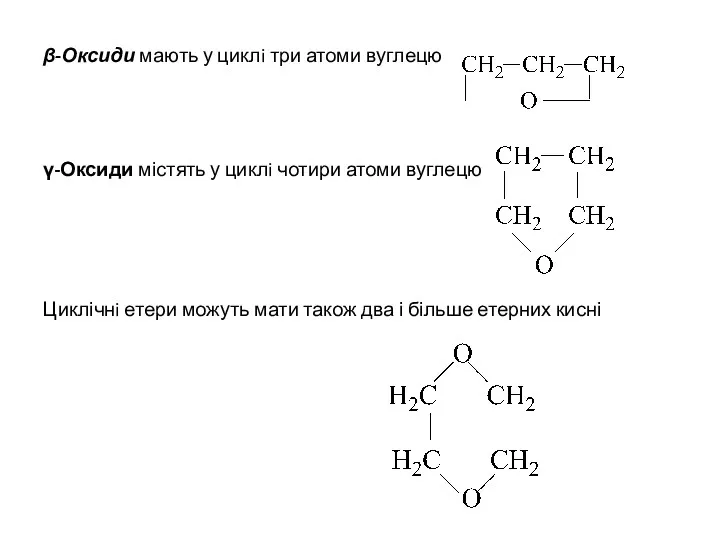
- 9. β-Оксиди мають у циклi три атоми вуглецю γ-Оксиди містять у циклi чотири атоми вуглецю Циклічнi етери
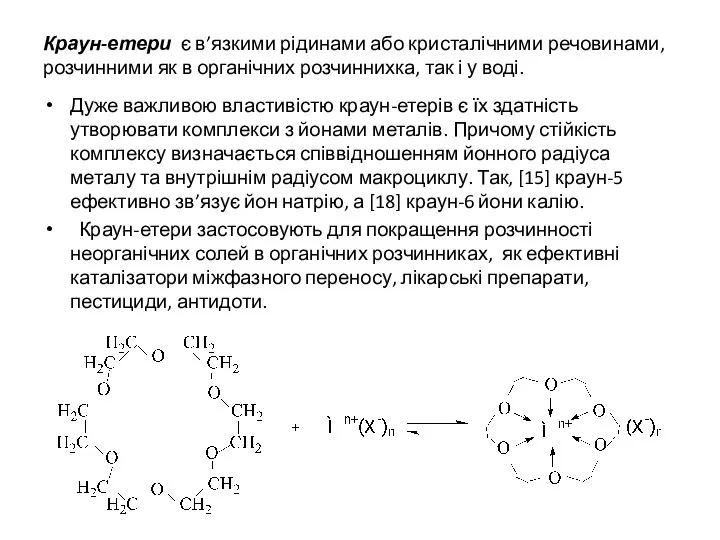
- 10. В особливу групу виділенi циклічнi етери з кількома атомами кисню, що називаються краун-етерами [18]-Краун-6
- 11. Краун-етери є в’язкими рідинами або кристалічними речовинами, розчинними як в органічних розчиннихка, так і у воді.
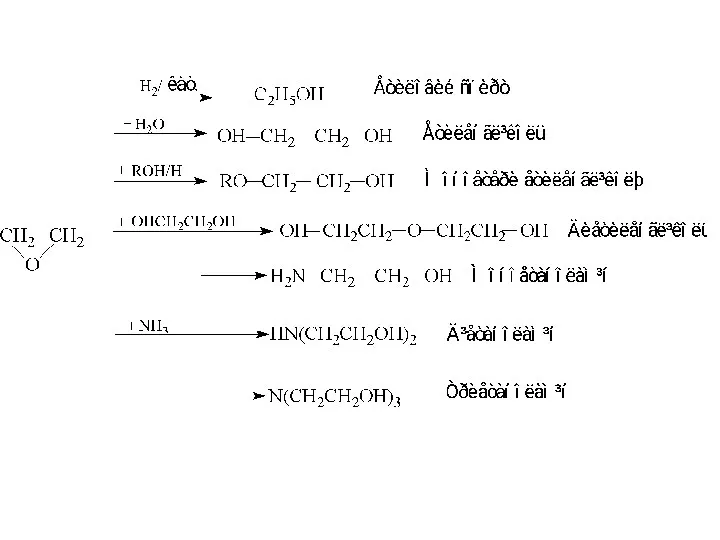
- 12. ОДЕРЖАННЯ ЕПОКСИДНИХ СПОЛУК 1. Епоксисполуки одержують з етену або пропену двома шляхами. З алкіленхлорогідринів - реакцією
- 13. ХІМІЧНІ ВЛАСТИВОСТІ ЕПОКСИДНИХ СПОЛУК Епоксидне кільце має вигляд правильного трикутника зі значно деформованими валентними кутами. Таке
- 14. Якщо епоксид реагує з речовиною Н-Х, то протонізований атом водню приєднується до кисню, а нуклеофільна частина
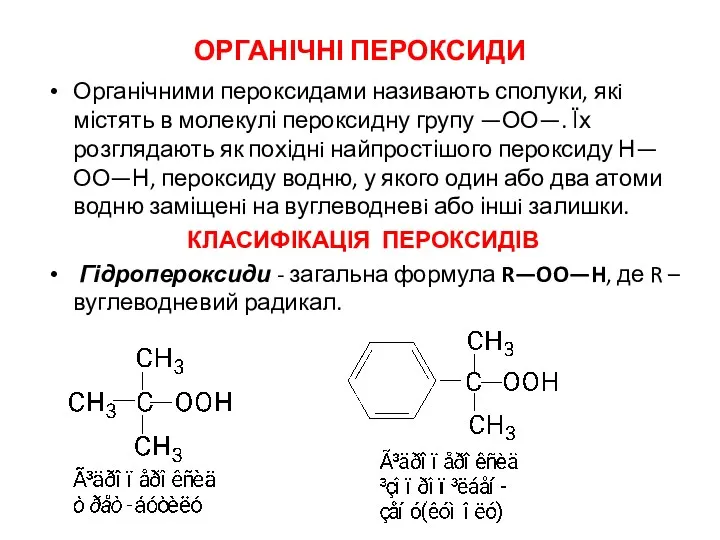
- 17. ОРГАНІЧНІ ПЕРОКСИДИ Органічними пероксидами називають сполуки, якi містять в молекулі пероксидну групу —ОО—. Їх розглядають як
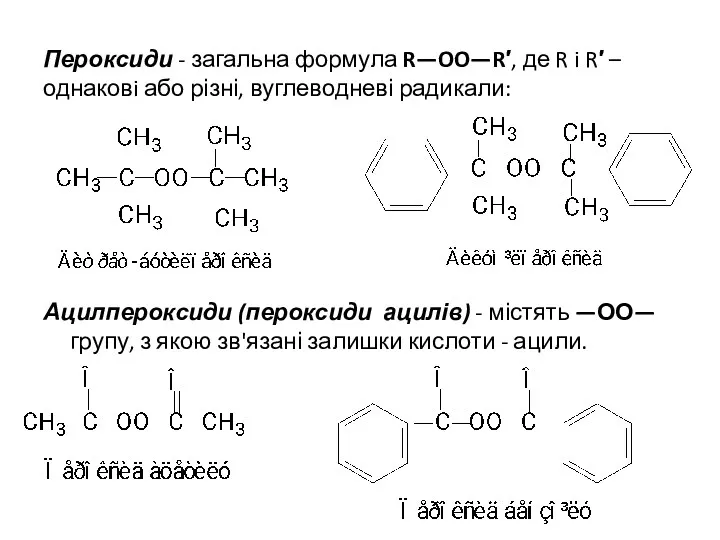
- 18. Пероксиди - загальна формула R—OO—R′, де R i R′ – однаковi або різні, вуглеводневі радикали: Ацилпероксиди
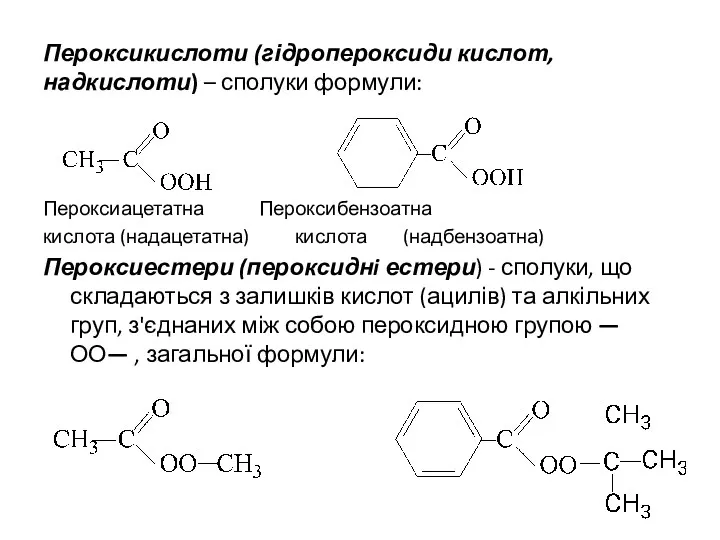
- 19. Пероксикислоти (гідропероксиди кислот, надкислоти) – сполуки формули: Пероксиацетатна Пероксибензоатна кислота (надацетатна) кислота (надбензоатна) Пероксиестери (пероксиднi естери)
- 21. Скачать презентацию




![В особливу групу виділенi циклічнi етери з кількома атомами кисню, що називаються краун-етерами [18]-Краун-6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/343508/slide-9.jpg)



 Классификация химических реакций
Классификация химических реакций Неметаллы
Неметаллы Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Теория электролитической диссоциации
Теория электролитической диссоциации Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері
Органикалық химияға кіріспе. Органикалық заттардың ерекшеліктері Мартенситное превращение
Мартенситное превращение Химическая термодинамика. Термохимия. Лекция 6
Химическая термодинамика. Термохимия. Лекция 6 Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Производство полимеров
Производство полимеров Соли, их классификация и свойства
Соли, их классификация и свойства Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Химическая промышленность
Химическая промышленность Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Магматические горные породы
Магматические горные породы Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Удивительные свойства воды
Удивительные свойства воды Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Спирты. Определение. Классификация
Спирты. Определение. Классификация CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Поняття про побутові хімікати
Поняття про побутові хімікати Реакции ионного обмена
Реакции ионного обмена Неорганические вяжущие вещества. (Лекция 6)
Неорганические вяжущие вещества. (Лекция 6) Алкалоиды
Алкалоиды Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Кристаллические решетки
Кристаллические решетки Арены. Бензол
Арены. Бензол