Содержание
- 2. Раствор – это гомогенная, многокомпонентная система переменного состава, содержащая продукты взаимодействия компонентов – сольваты (для водных
- 3. Растворы состоят как минимум из двух компонентов: растворителя и растворяемого вещества. Растворитель – это тот компонент,
- 4. Растворенным веществом является компонент, взятый в недостатке, или компонент, агрегатное состояние которого изменяется при образовании раствора.
- 5. . Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с
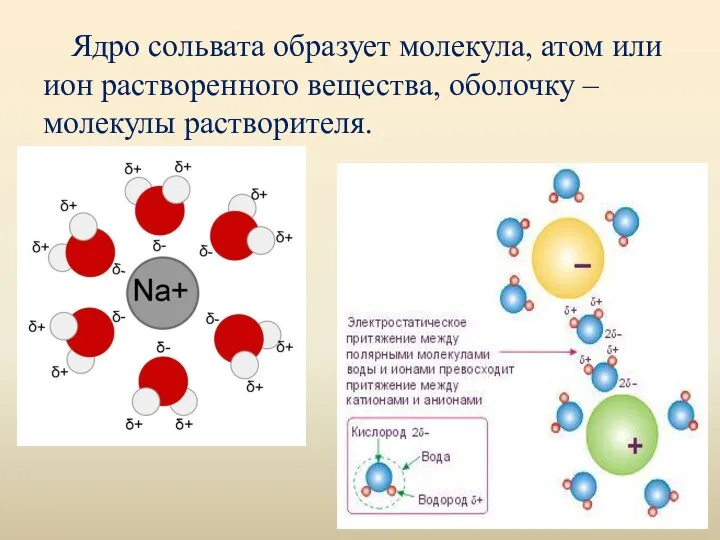
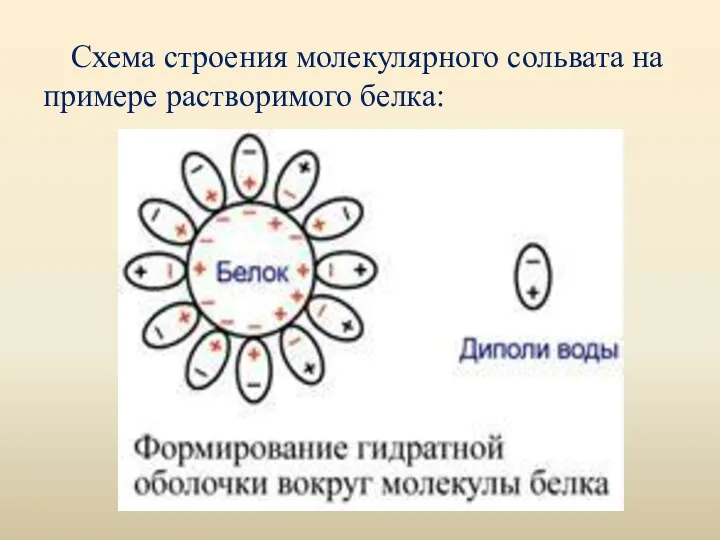
- 6. Ядро сольвата образует молекула, атом или ион растворенного вещества, оболочку – молекулы растворителя.
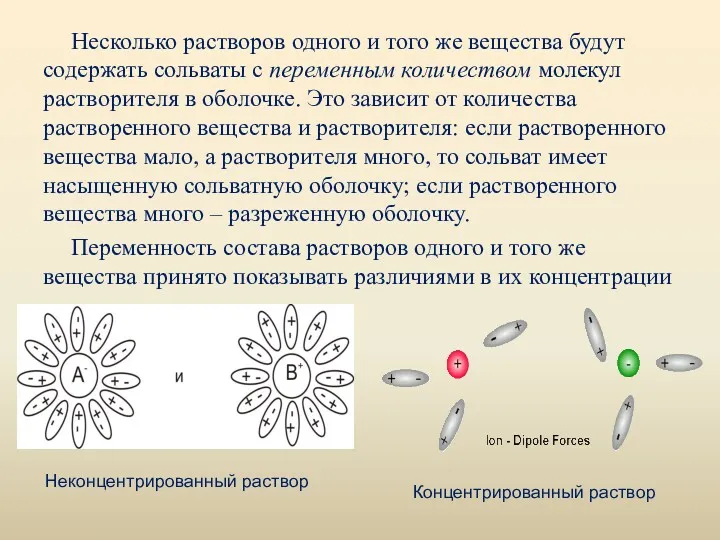
- 7. Несколько растворов одного и того же вещества будут содержать сольваты с переменным количеством молекул растворителя в
- 8. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействия или за счет водородных связей. Особенно склонны к
- 9. Растворение как физико-химический процесс Процесс растворения (по своей сути физический процесс дробления вещества) вследствие образования сольватов
- 10. выделением газа или выпадением осадка (в результате происходящего гидролиза); изменением цвета раствора относительно цвета растворяемого вещества
- 11. Классификации растворов 1. По агрегатному состоянию: - жидкие; - твердые (многие сплавы металлов, стёкла).
- 12. 2. По количеству растворенного вещества: - ненасыщенные растворы: в них растворенного вещества меньше, чем может растворить
- 13. - насыщенные растворы – это растворы, в которых растворенного вещества столько, сколько может растворить данный растворитель
- 14. - пересыщенные растворы – это растворы, в которых растворяемого вещества больше, чем может растворить растворитель при
- 15. Пересыщенные растворы образуются только в экстремальных условиях: при высокой температуре (сахарный сироп) или высоком давлении (газированные
- 16. Пересыщенные растворы неустойчивы и при возврате к нормальным условиям «стареют»,т.е. расслаиваются. Избыток растворенного вещества кристаллизуется или
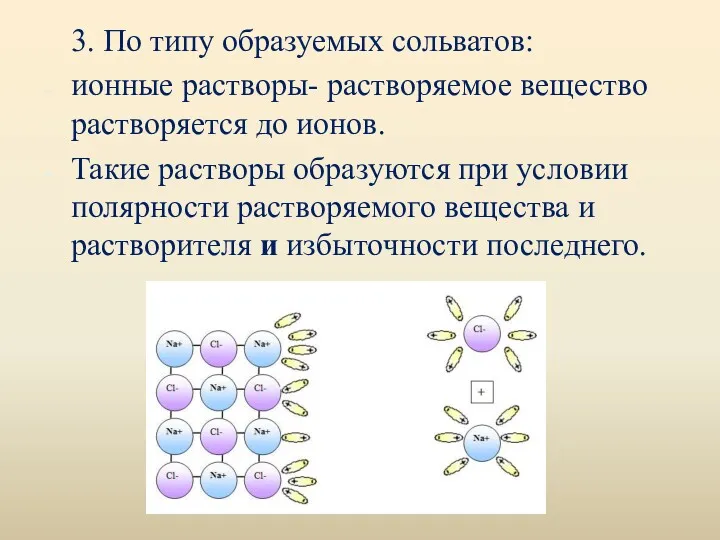
- 18. 3. По типу образуемых сольватов: ионные растворы- растворяемое вещество растворяется до ионов. Такие растворы образуются при
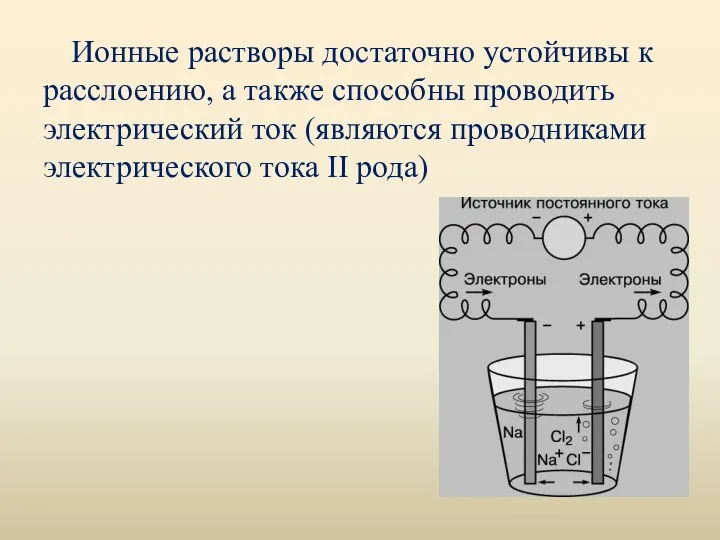
- 19. Ионные растворы достаточно устойчивы к расслоению, а также способны проводить электрический ток (являются проводниками электрического тока
- 20. - молекулярные растворы – растворяемое вещество распадается только до молекул. Такие растворы образуются при условии: -
- 21. Схема строения молекулярного сольвата на примере растворимого белка:
- 22. Факторы, влияющие на процесс растворения 1. Химическая природа вещества. Непосредственное влияние на процесс растворения веществ оказывает
- 23. 2. Температура. Для большинства жидких и твердых веществ характерно увеличение растворимости при повышении температуры. Растворимость газов
- 24. 3. Давление. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением – уменьшается. На
- 25. Способы выражения концентрации растворов Существуют различные способы выражения состава раствора. Наиболее часто используются такие, как массовая
- 26. Массовая доля растворённого вещества Это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора:
- 27. Молярная концентрация Показывает, сколько моль растворённого вещества содержится в 1 литре раствора: Мвещества - молярная масса
- 28. Массовая концентрация Указывает на массу вещества, находящегося в одном литре раствора: Единица измерения – г/л. Данным
- 29. Теория электролитической диссоциации
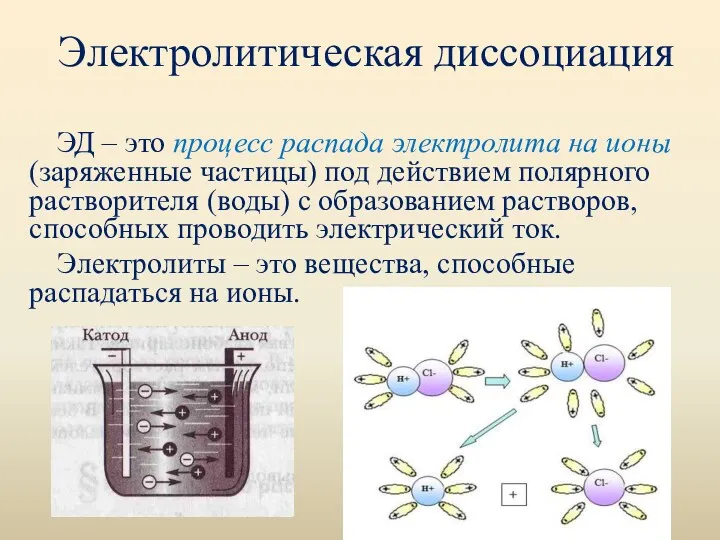
- 30. Электролитическая диссоциация ЭД – это процесс распада электролита на ионы (заряженные частицы) под действием полярного растворителя
- 31. Электролитическая диссоциация Электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества. Это взаимодействие приводит
- 32. Электролитическая диссоциация Количественно ЭД характеризуется степенью диссоциации (α); она выражает отношение продиссоциированных молекул на ионы к
- 33. Электролитическая диссоциация Характер ионов, образующихся при диссоциации электролитов – различен. В молекулах солей при диссоциации образуются
- 34. Электролитическая диссоциация По степени диссоциации все вещества можно разделить на 4 группы: 1. Сильные электролиты (α>30%):
- 35. Электролитическая диссоциация 2. Средние электролиты (3% кислоты – H3PO4, H2SO3, HNO2 ; двухосновные, растворимые в воде
- 36. Электролитическая диссоциация 3. Слабые электролиты (0,3% низшие органические кислоты (CH3COOH, C2H5COOH); некоторые растворимые в воде неорганические
- 37. Электролитическая диссоциация 4. Неэлектролиты (α≤0,3%): нерастворимые в воде соли, кислоты и основания; большинство органических соединений (как
- 38. Электролитическая диссоциация Одно и то же вещество может быть как сильным, так и слабым электролитом. Например,
- 40. Ионное произведение воды Вода, хотя и является слабым электролитом, частично диссоциирует: H2O + H2O ↔ H3O+
- 41. Ионное произведение воды При растворении в воде какого-либо вещества равенство концентраций ионов [H+] = [OH−] =
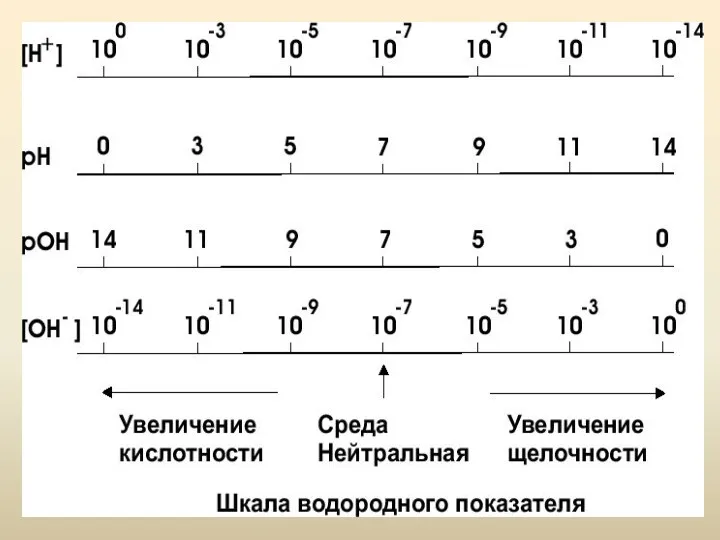
- 42. Ионное произведение воды Для удобства представления результатов кислотности/щелочности среды пользуются не абсолютными значениями концентраций, а их
- 43. Ионное произведение воды В нейтральной среде [H+] = [OH−] = 10-7 моль/л и: При добавлении к
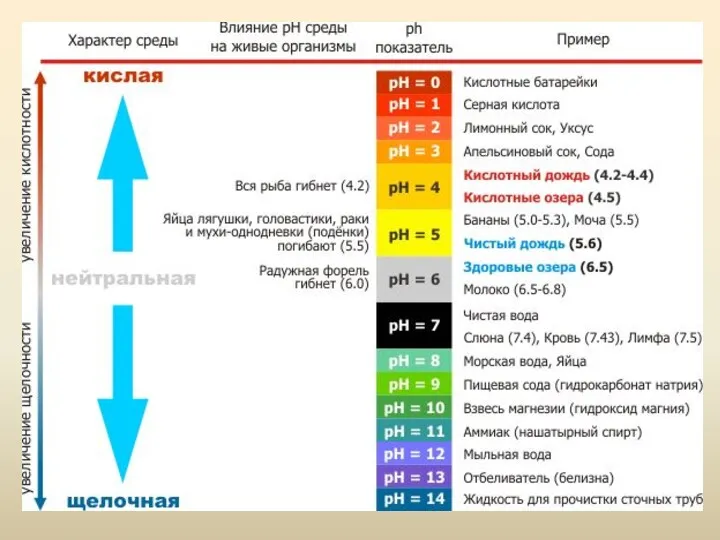
- 45. Водородный показатель. Индикаторы Для определения рН используют кислотно-основные индикаторы – вещества, меняющие свой цвет в зависимости
- 47. Гидролиз солей Слово «гидролиз» буквально означает «разложение водой». Гидролиз – это процесс взаимодействия ионов растворенного вещества
- 49. Гидролиз солей. Правила написания 1. Для облегчения написания уравнений гидролиза все вещества делят на 2 группы:
- 50. Гидролиз солей. Правила написания 3. Для определения полноты гидролиза и рН раствора записывают 3 уравнения: 1)
- 51. Гидролиз солей 1. Гидролиз соли, образованной сильным основанием и сильной кислотой: Na+Cl- + H+OH- ↔ Na+OH-
- 52. Гидролиз солей 2. Гидролиз соли, образованной сильным основанием и слабой кислотой: C17H35COO-Na+ + H+OH- ↔ Na+OH-
- 53. Гидролиз солей 3. Гидролиз соли, образованной слабым основанием и сильной кислотой: Sn+2Cl2- + 2H+OH- ↔ Sn+2(OH-)2
- 54. Гидролиз солей 4. Гидролиз соли, образованной слабым основанием и слабой кислотой: Попробуем получить в реакции обмена
- 56. Скачать презентацию



































![Ионное произведение воды В нейтральной среде [H+] = [OH−] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212513/slide-42.jpg)








 Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс VII A тобы. Галогендер
VII A тобы. Галогендер Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов Процесс оксихлорирования
Процесс оксихлорирования Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Гидроочистка нефти и газа
Гидроочистка нефти и газа Основные типы химический реакций
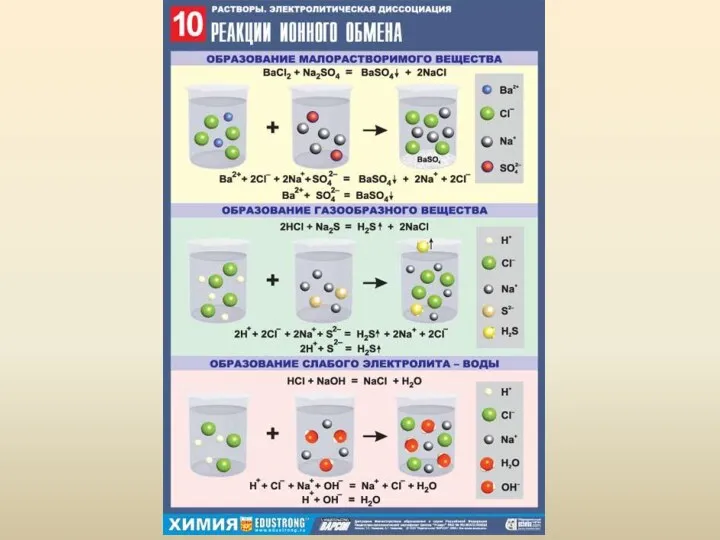
Основные типы химический реакций Теория электролитической диссоциации
Теория электролитической диссоциации Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Простые эфиры
Простые эфиры Аллотропные модификации углерода. Алмазы
Аллотропные модификации углерода. Алмазы Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Нанохимия
Нанохимия Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы Кислородные соединения азота
Кислородные соединения азота Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Химические элементы и организм человека
Химические элементы и организм человека Основные классы неорганических соединений. Тема 2
Основные классы неорганических соединений. Тема 2 Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Аналитические методы
Аналитические методы Средства бытовой химиии
Средства бытовой химиии Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Ароматические углеводороды
Ароматические углеводороды