Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка презентация
Содержание
- 2. Физико-химические свойства аминокислот Амфотерность является основным физико-химическим свойством аминокислот, то есть сочетают в себе свойства как
- 3. Кислотно-основные свойства аминокислот Стандартная аминокислота, содержащая α-карбоксильную и α-аминогруппы, в водном растворе представляет собой цвиттер-ион. Такие
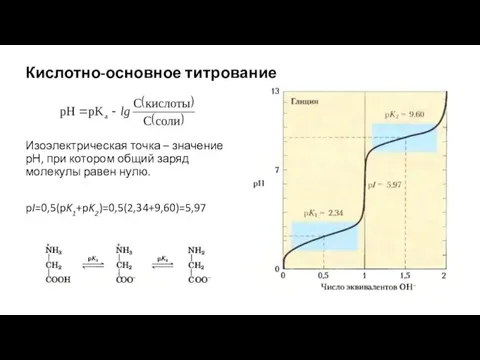
- 4. Кислотно-основное титрование Изоэлектрическая точка – значение рН, при котором общий заряд молекулы равен нулю. pI=0,5(pK1+pK2)=0,5(2,34+9,60)=5,97
- 5. pI=0,5(pK1+pKR)=0,5(2,19+4,25)=3,22 Кислотно-основное титрование кислой аминокислоты
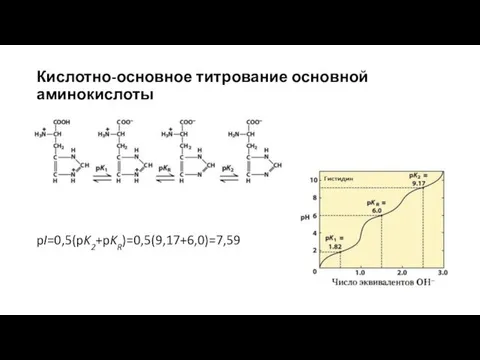
- 6. pI=0,5(pK2+pKR)=0,5(9,17+6,0)=7,59 Кислотно-основное титрование основной аминокислоты
- 7. Химические свойства аминокислот 1) Образование солей как с кислотами (по группе NH2), так и со щелочами
- 8. Химические свойства аминокислот Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы
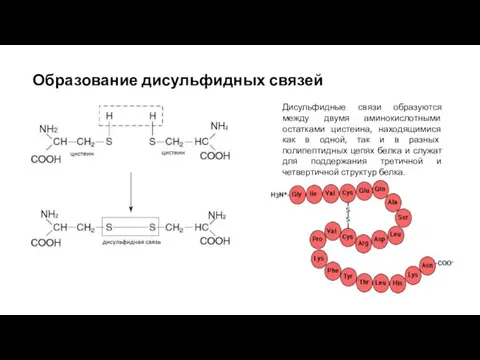
- 9. Образование дисульфидных связей Дисульфидные связи образуются между двумя аминокислотными остатками цистеина, находящимися как в одной, так
- 10. Метод Сэнджера Метод основан на реакции арилирования N-концевой аминокислоты полипептида 2,4-динитрофторбензолом (ДНФБ), что приводит к образованию
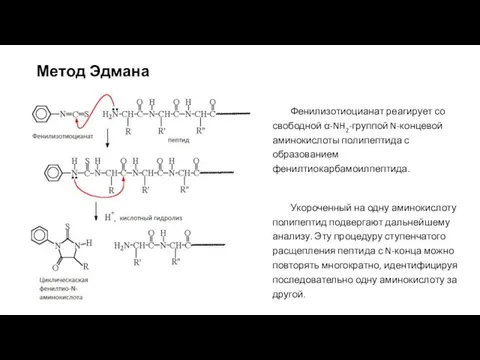
- 11. Метод Эдмана Фенилизотиоцианат реагирует со свободной α-NH2-группой N-концевой аминокислоты полипептида с образованием фенилтиокарбамоилпептида. Укороченный на одну
- 12. Качественные реакции на аминокислоты Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах, а также
- 13. Ксантопротеиновая реакция Ксантопротеиновая реакция на белки, в которых присутствуют ароматические аминокислоты. Особенностью такой пробы является присоединение
- 14. Реакция Фоля Реакция Миллона
- 15. Оптические свойства аминокислот α-аминокислоты имеют асимметричный атом углерода (кроме глицина) и существуют в виде двух стереоизомеров,
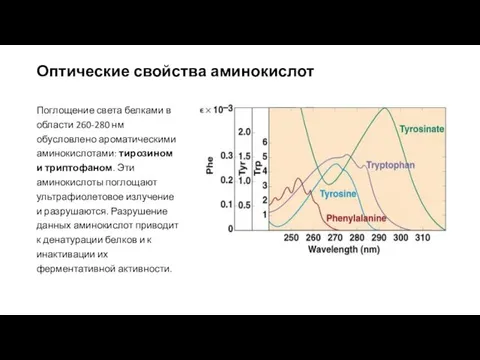
- 16. Поглощение света белками в области 260-280 нм обусловлено ароматическими аминокислотами: тирозином и триптофаном. Эти аминокислоты поглощают
- 17. Методы количественного определения белков Спектрофотометрические методы Колориметрические методы Основаны на способности отдельных химических групп белков и
- 18. Спектрофотометрический метод определения концентрации белков Закон Бугера-Ламберта-Бера
- 19. Колориметрические методы Биуретовая реакция – стандартная качественная реакция на пептидную связь в белках. При добавлении к
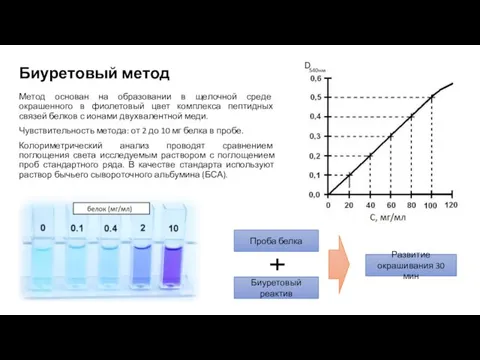
- 20. Биуретовый метод Метод основан на образовании в щелочной среде окрашенного в фиолетовый цвет комплекса пептидных связей
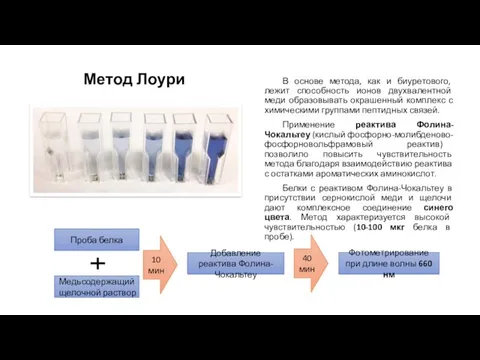
- 21. Метод Лоури В основе метода, как и биуретового, лежит способность ионов двухвалентной меди образовывать окрашенный комплекс
- 22. Денатурация белков – нарушение трехмерной структуры белка, способное повлечь за собой потерю его функций. При денатурации
- 23. Осаждение белков Обратимое (высаливание) Необратимое (использование минеральных и органических кислот) В дистиллированной воде белки растворяются плохо,
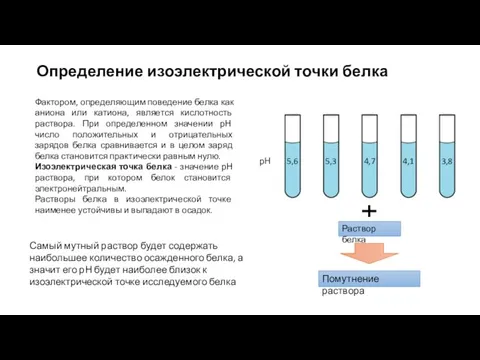
- 24. Определение изоэлектрической точки белка рН 4,7 5,3 4,1 3,8 5,6 Фактором, определяющим поведение белка как аниона
- 26. Скачать презентацию















 Воздух и его состав
Воздух и его состав Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Химическая связь
Химическая связь Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Углеводы. Моносахариды
Углеводы. Моносахариды Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Полімери. Природні полімери
Полімери. Природні полімери Соединения галогенов
Соединения галогенов Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций Аминокислоты. Что нужно для настоящего атлета?
Аминокислоты. Что нужно для настоящего атлета? Насыщенные углеводороды
Насыщенные углеводороды Классы неорганических соединений
Классы неорганических соединений Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Минералы и их строение
Минералы и их строение Қайтымды реакция. Химиялық тепе-теңдік
Қайтымды реакция. Химиялық тепе-теңдік Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Жуғыш заттардың адам өміріндегі маңызы
Жуғыш заттардың адам өміріндегі маңызы Минералы. Принципы классификации минералов
Минералы. Принципы классификации минералов Биосенсорные системы
Биосенсорные системы Строение атома. Лекция 2
Строение атома. Лекция 2 Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты