Содержание
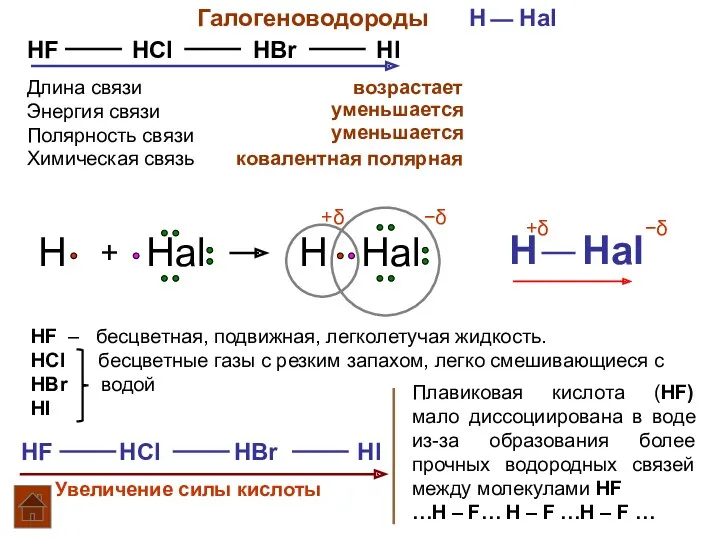
- 2. Галогеноводороды H Hal HF HCl HBr HI Длина связи Энергия связи Полярность связи возрастает уменьшается уменьшается
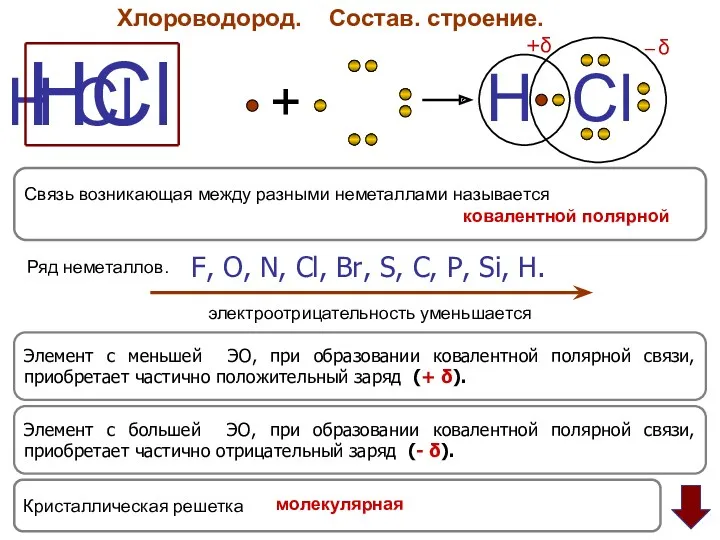
- 3. Хлороводород. Состав. строение. HCl H Cl + H Cl +δ ─ δ Элемент с большей ЭО,
- 5. Получение хлороводорода В лаборатории для получения HCl используют реакцию обмена между кристаллическим хлоридом натрия и концентрированной
- 6. Физические свойства хлороводорода Хлороводород – это газ с резким запахом, без цвета, очень хорошо растворим в
- 7. Соляная кислота (HCl) Классификация Соляная кислота по: наличию кислорода: основности: растворимости в воде: летучести: степени электролитической
- 8. Физические свойства соляной кислоты Соляная кислота – бесцветная дымящаяся на воздухе жидкость (в продажу поступает 36%-ный
- 9. Химические свойства соляной кислоты 1. Действие соляной кислоты на индикаторы 2. Взаимодействие с металлами 3. Взаимодействие
- 10. Соляная кислота необратимо диссоциирует в водном растворе. Составьте уравнение диссоциации соляной кислоты. HCl = H+ +
- 11. Взаимодействие соляной кислоты с металлами Составьте уравнение реакции соляной кислоты с цинком. Рассмотрите с т.зр. ТЭД
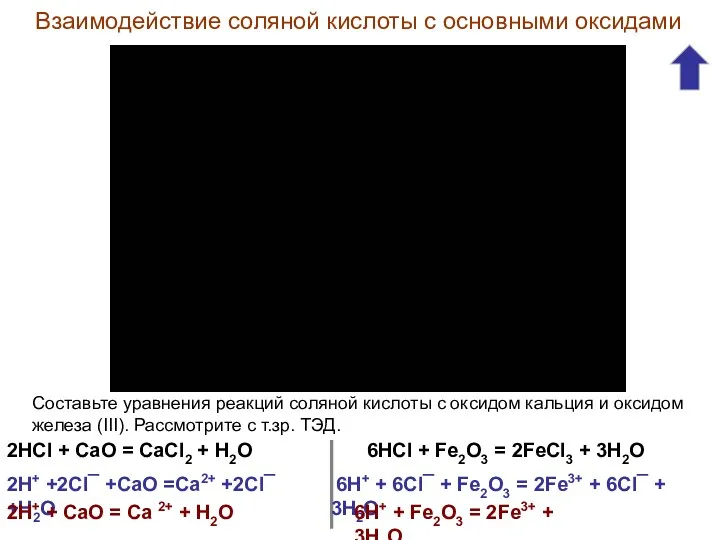
- 12. Взаимодействие соляной кислоты с основными оксидами Составьте уравнения реакций соляной кислоты с оксидом кальция и оксидом
- 13. Реакция нейтрализации Составьте уравнения реакций соляной кислоты c гидроксидом натрия. Рассмотрите с т.зр. ТЭД. HCl +
- 14. Взаимодействие соляной кислоты с солями Составьте уравнения реакций соляной кислоты c карбонатом натрия натрия. Рассмотрите с
- 15. Применение соляной кислоты 1. Получение солей 4. При паянии 3. Приготовление лекарств 2. Производство пластмасс и
- 16. HCl 1 3 2 4 5 6
- 17. Соли соляной кислоты (хлориды) Хлорид натрия 1. Состав NaCl 2. Строение Химическая связь между катионами и
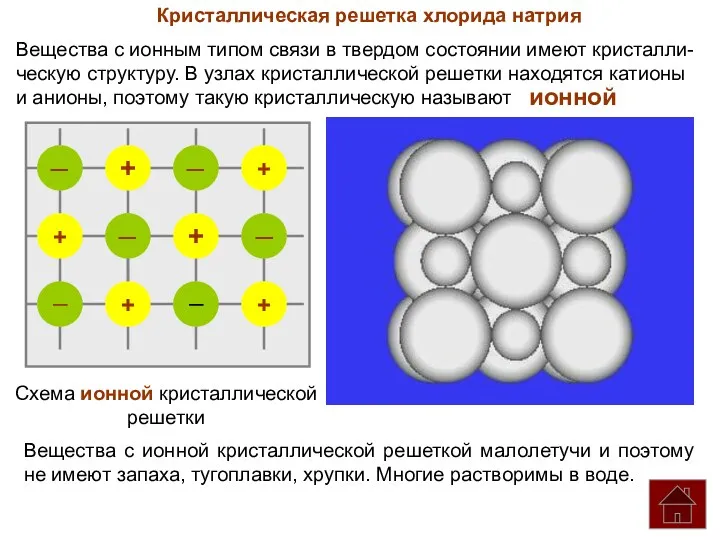
- 18. Кристаллическая решетка хлорида натрия Вещества с ионным типом связи в твердом состоянии имеют кристалли- ческую структуру.
- 19. Качественное определение галогенид-ионов На соляную кислоту и ее соли хлориды, равно как на HBr и бромиды,
- 21. Скачать презентацию














 Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Кинетика химических реакций
Кинетика химических реакций Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Химический элементы в нашей жизни
Химический элементы в нашей жизни Functions of proteins
Functions of proteins Общая характеристика неметаллов
Общая характеристика неметаллов Относительная атомная масса
Относительная атомная масса Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Строение электронных оболочек атомов
Строение электронных оболочек атомов Процесс оксихлорирования
Процесс оксихлорирования Посуда, ее виды и использование
Посуда, ее виды и использование Минералы для ИЗБ
Минералы для ИЗБ Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Синтез нуклеотидов
Синтез нуклеотидов Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Строение и свойства циклоалканов
Строение и свойства циклоалканов Электронное строение атома
Электронное строение атома Минерализация, иммобилизация, нитрификация және денитрификация процестері
Минерализация, иммобилизация, нитрификация және денитрификация процестері Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Химическая коррозия
Химическая коррозия Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Серная кислота H2SO4
Серная кислота H2SO4