Содержание
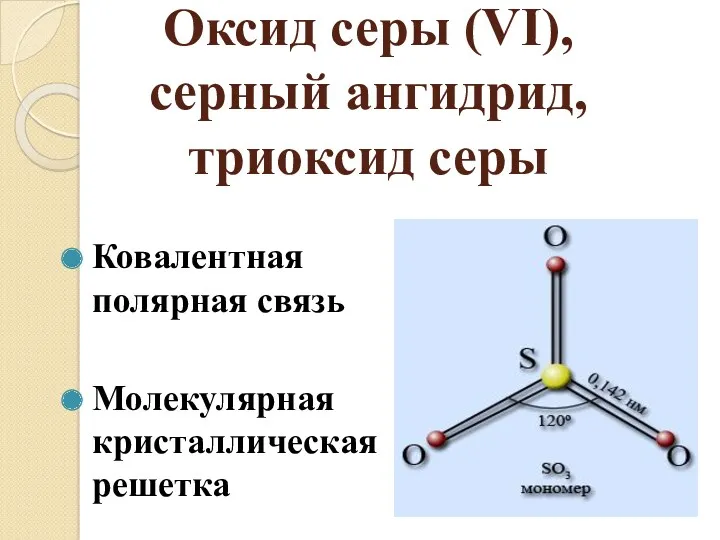
- 2. Оксид серы (VI), серный ангидрид, триоксид серы Ковалентная полярная связь Молекулярная кристаллическая решетка
- 3. Физические свойства серного ангидрида Бесцветная, летучая, маслянистая жидкость, t° пл. = 17°C; t° кип. = 45°С;
- 4. Химические свойства I. - SO3 кислотный оксид 1)… 2)… 3)…
- 5. Химические свойства оксида серы (IV) 1. Кислотный оксид +Вода= Кислота SO3 + H2O = H2SO4 2.
- 6. Получение оксида серы (VI) 1. Окисление оксида серы (IV) …
- 7. Получение оксида серы (VI) SO2 + O2 = SO3 Оксид Оксид серы (IV) серы (VI)
- 8. H2SO4 серная кислота Дать классификацию серной кислоте.
- 9. По основности: двухосновная По наличию кислорода: кислородосодержащая По силе: сильный электролит H2SO4 классификация
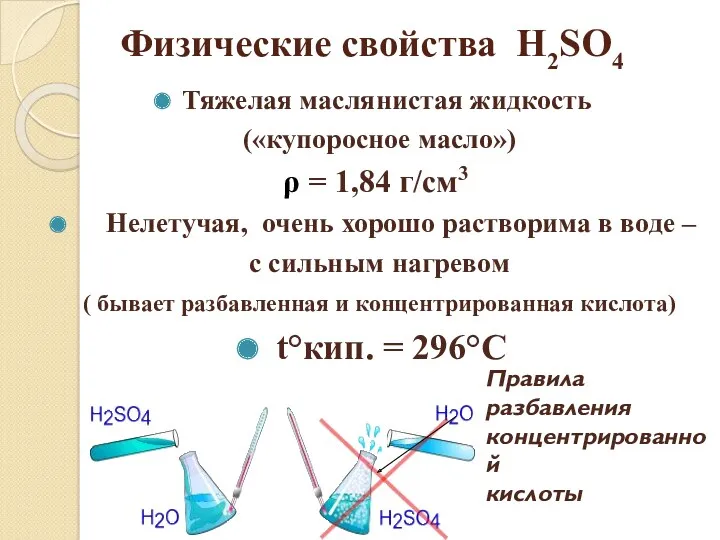
- 10. Тяжелая маслянистая жидкость («купоросное масло») ρ = 1,84 г/см3 Нелетучая, очень хорошо растворима в воде –
- 11. Химические свойства H2SO4 С металлами (в ряду активности металлов до Н): H2SO4+Zn = … + …
- 12. Химические свойства H2SO4 С металлами (в ряду активности металлов до Н): H2SO4+Zn=ZnSO4 + H2 2. С
- 13. Качественная реакция на ион SO42- Реактивом на серную кислоту и ее соли является катион бария ,
- 14. Концентрированная серная кислота Серная кислота(конц) восстанавливается до (Н2S,S,SO2) в зависимости от активности металла и условий протекания
- 15. Автоцистерна для перевозки серной кислоты
- 17. Скачать презентацию












 Оксид серы (IV). Сернистая кислота
Оксид серы (IV). Сернистая кислота Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Строение атома. 10 ен
Строение атома. 10 ен Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Ароматические кислоты и их соли
Ароматические кислоты и их соли Амины и их свойства
Амины и их свойства Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Газы, применяемые при сварке
Газы, применяемые при сварке Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Коррозия металлов
Коррозия металлов История мыловарения
История мыловарения Твердые вещества
Твердые вещества Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП)
Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП) Мыловарение. Мыло своими руками
Мыловарение. Мыло своими руками Азотная кислота и нитраты
Азотная кислота и нитраты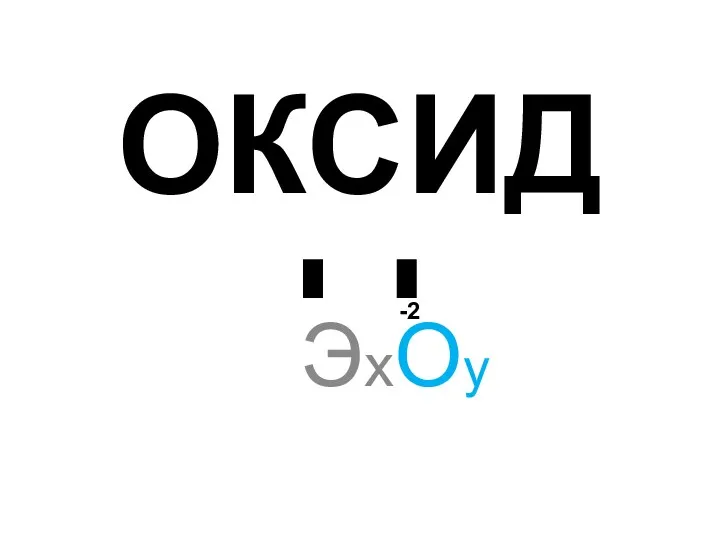 Химические свойства оксидов
Химические свойства оксидов Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Жиры и масла
Жиры и масла Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Prezentatsia
Prezentatsia Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) История открытия фосфора
История открытия фосфора