Содержание
- 2. Ароматические соединения (от греч. árômа — благовоние), класс органических циклических соединений, все атомы которых участвуют в
- 3. Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные
- 4. История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году
- 5. Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком
- 6. В 1833 году немецкий физик и химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли
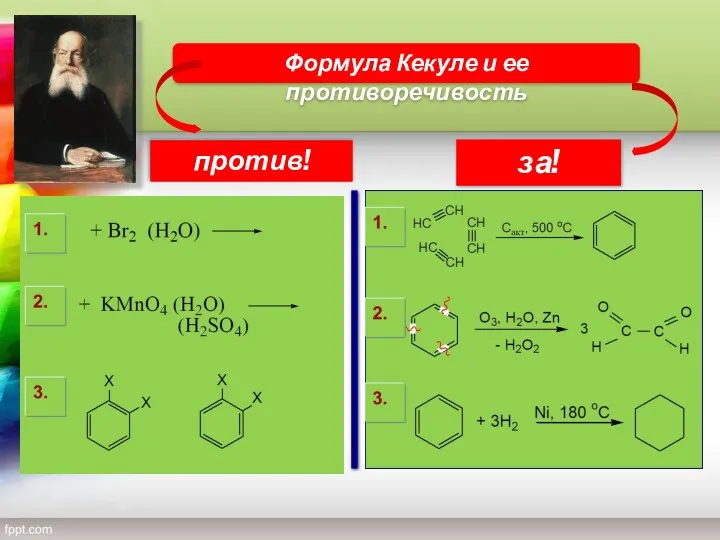
- 7. Структурная формула бензола Была предложена немецким ученым А. Кекуле в 1865 году Бензол не взаимодействует с
- 8. Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
- 9. Формула Кекуле и ее противоречивость против! за!
- 10. Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из
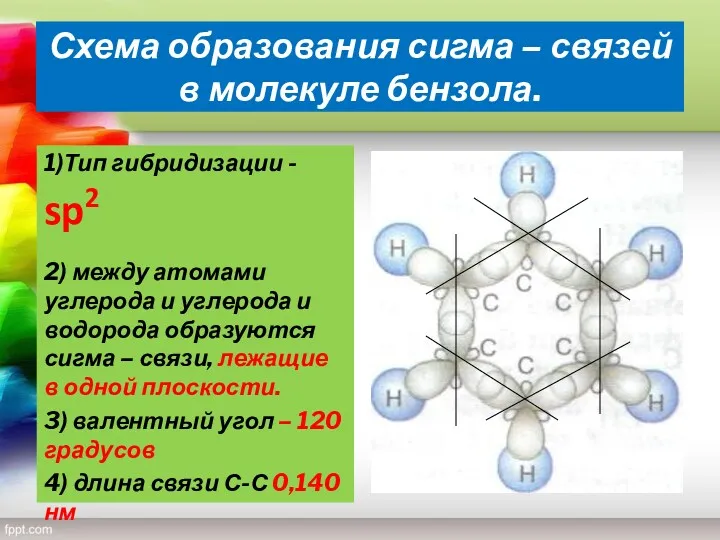
- 11. Схема образования сигма – связей в молекуле бензола. 1)Тип гибридизации - sp2 2) между атомами углерода
- 12. Схема образования пи – связей в молекуле бензола За счет негибридных р – электронных облаков в
- 13. Электронное строение бензола Современное представление об электронной природе связей в бензоле основывается на гипотезе американского физика
- 14. Современная структурная формула бензола. Сочетание шести сигма – связей с единой π – системой называется ароматической
- 15. Реакции замещения. 1) Галогенирование При взаимодействии бензола с галогеном (в данном случае с хлором) атом водорода
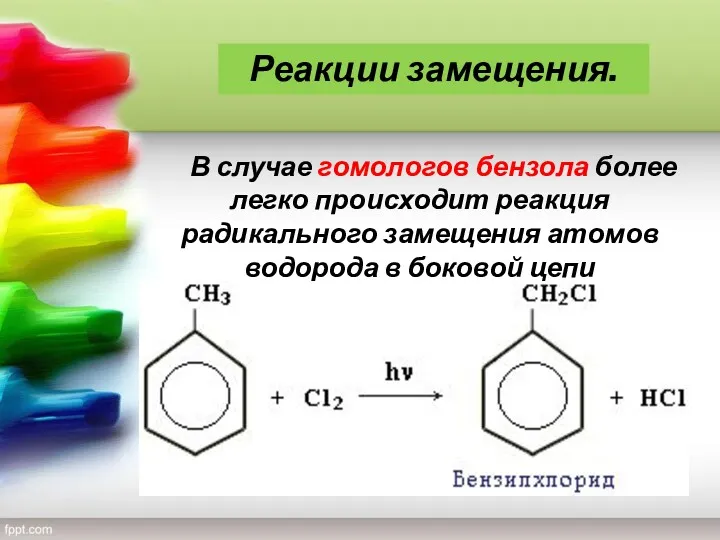
- 16. В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи Реакции
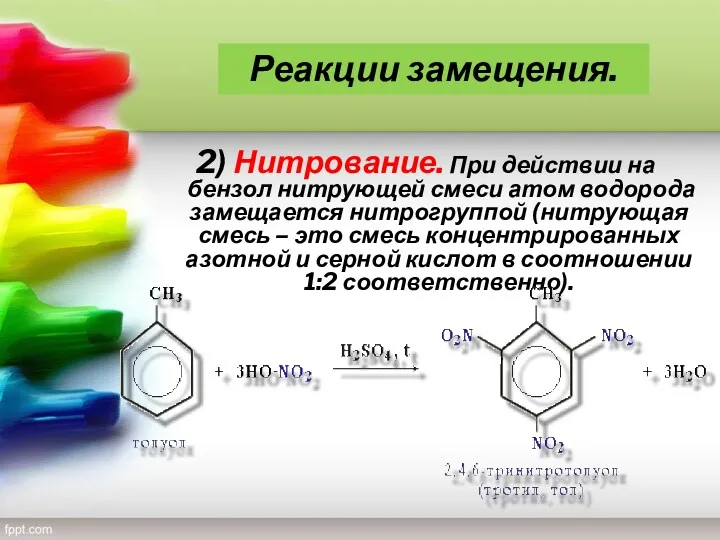
- 17. 2) Нитрование. При действии на бензол нитрующей смеси атом водорода замещается нитрогруппой (нитрующая смесь – это
- 18. 3) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В процессе реакции водородный атом замещается сульфогруппой. SO3
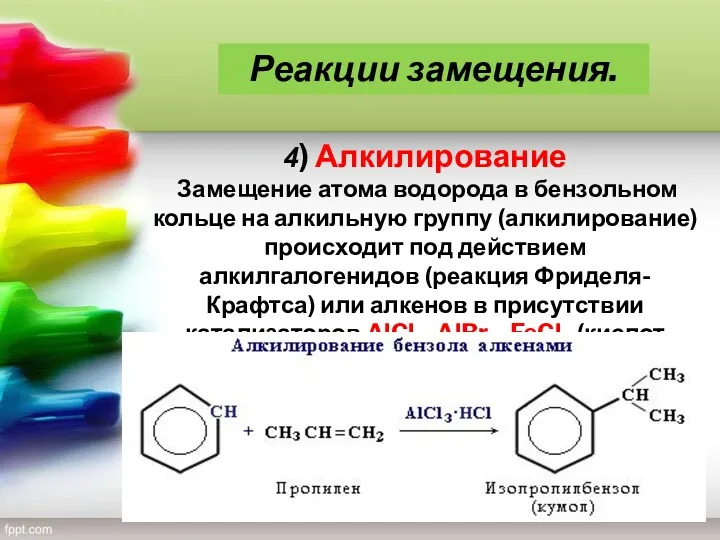
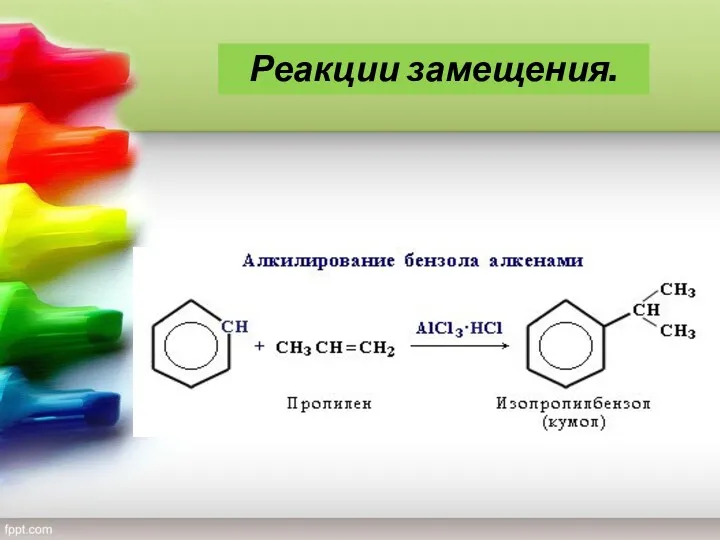
- 19. 4) Алкилирование Замещение атома водорода в бензольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов
- 20. Реакции замещения.
- 21. Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом. Например, при
- 22. Несмотря на склонность бензола к реакциям замещения, он в жестких условиях вступает и в реакции присоединения.
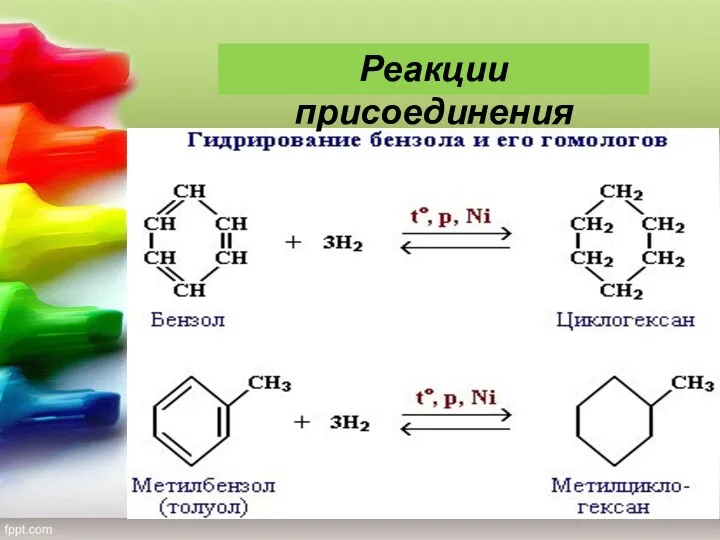
- 23. 5) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с
- 24. Реакции присоединения
- 25. 6) Галогенирование. Радикальное хлорирование В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к
- 26. Реакции присоединения
- 27. Запомните Если в молекуле бензола один из атомов водорода замещен на углеводородный радикал, то в дальнейшем
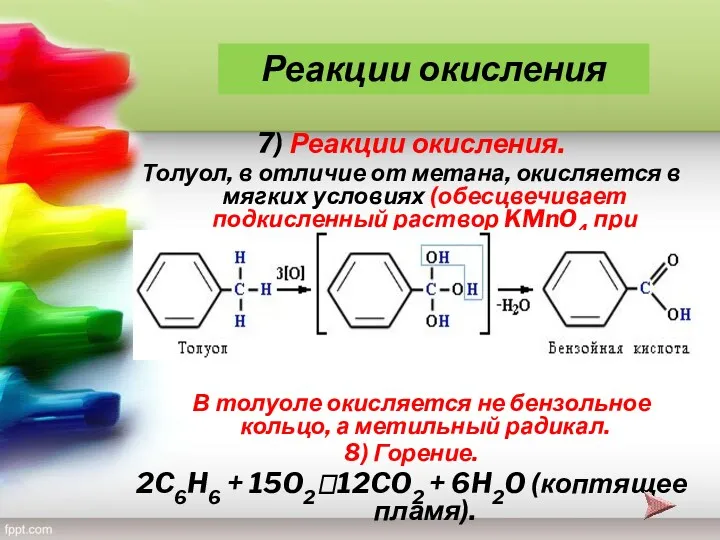
- 28. 7) Реакции окисления. Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4
- 29. 1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется
- 30. 2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина
- 31. 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский). 600°C 3C2H2 –→
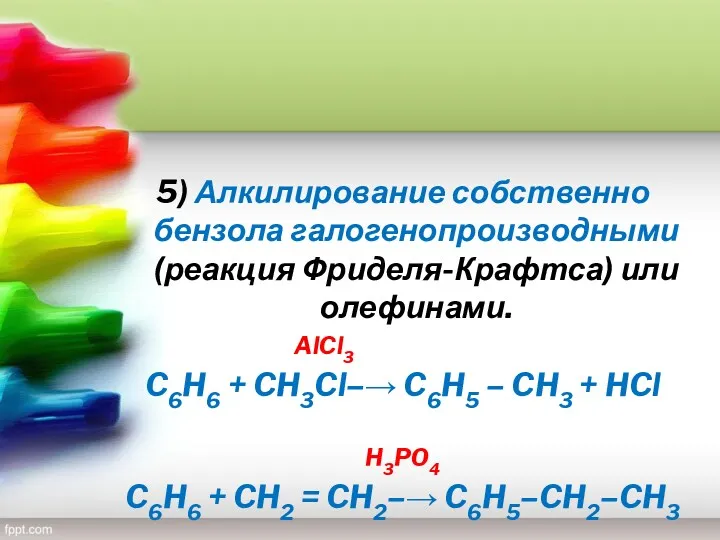
- 32. 5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами. AlCl3 C6H6 + CH3Cl–→ C6H5 – CH3
- 33. Применение Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина,
- 35. Скачать презентацию























 Бензин: догадкии реальность
Бензин: догадкии реальность Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Нафталин
Нафталин Кристаллические и аморфные тела
Кристаллические и аморфные тела Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Диеновые углеводороды
Диеновые углеводороды Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Группы сходных химических элементов
Группы сходных химических элементов Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Коллоидная химия
Коллоидная химия Соли. Названия солей
Соли. Названия солей Определение критических точек двойного сплава
Определение критических точек двойного сплава Твердые вещества
Твердые вещества Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Водород
Водород Неметаллы. 11 класс
Неметаллы. 11 класс Предмет и история геохимии
Предмет и история геохимии Основания: номенклатура, классификация, применение, физические свойства. 8 класс
Основания: номенклатура, классификация, применение, физические свойства. 8 класс Простые и сложные эфиры
Простые и сложные эфиры Железо и его сплавы
Железо и его сплавы Химические реакции. Урок-обобщение
Химические реакции. Урок-обобщение Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Полипропилен
Полипропилен Соли. 11 класс
Соли. 11 класс Алканы
Алканы