Содержание
- 2. По каким признакам можно классифицировать химические реакции? Какие типы химических реакций существуют? Какие реакции называются эндотермическими?
- 3. От каких факторов зависит скорость химической реакции? Как скорость химической реакции зависит от температуры? Как скорость
- 4. Дайте полную характеристику реакции: V2O5 2SO2 +O2 2SO3 +Q В какую сторону сместится химическое равновесие при:
- 5. Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10° до 50° С; б)
- 6. Вариант 1. Составить уравнения диссоциации следующих веществ: карбоната калия, хлорида алюминия, сульфата аммония,гидросульфата натрия. Вариант 2.
- 7. Даны соли: нитрат натрия, силикат калия, хлорид алюминия. При гидролизе одной из них среда раствора становится
- 8. Задание № 6. Допишите краткие ионные уравнения реакций гидролиза: А) CO32- +HOH Б)Fe2+ + HOH
- 9. Задание № 7. Расставьте коэффициенты в уравнении методом электронного баланса: KMnO4 + HCl Cl2+MnCl2+KCl+H2O Укажите окислитель
- 10. А1.Сокращённое ионное уравнение реакции 2H+ + CO3 2- → CO2 + H2O соответствует взаимодействию: а) азотной
- 11. А2.Осадок образуется при взаимодействии растворов веществ: Zn(NO3)2 и Na2SO4 2) Ba(OH)2 и NaCl 3) KCl и
- 12. А6.Сильными электролитами являются все вещества группы: 1) КОН, НNО3.Н2SО4; 2) Н2S, Н2SО3, Н2SО4; 3) МgСl2, СН3СООН,
- 13. Домашнее задание (повторить § 11-18 Подготовиться к контрольной работе
- 15. Скачать презентацию












 Платина. Физические и химические свойства
Платина. Физические и химические свойства Химические свойства соляной кислоты
Химические свойства соляной кислоты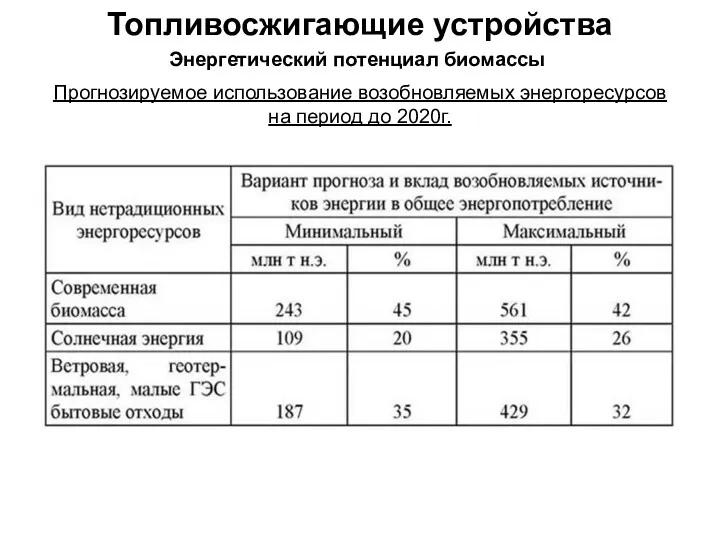 Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Метаболизм жирных кислот
Метаболизм жирных кислот Строительное материаловедение. Лекция 1
Строительное материаловедение. Лекция 1 Кислород
Кислород Preparation for COP
Preparation for COP Химия в кастрюле
Химия в кастрюле Моноядерні арени
Моноядерні арени Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Химические свойства спиртов
Химические свойства спиртов Синтетические моющие средства
Синтетические моющие средства Некоторые d-элементы
Некоторые d-элементы Виды топлива
Виды топлива Металлы побочных подгрупп
Металлы побочных подгрупп Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Элементы второй группы главной подгруппы
Элементы второй группы главной подгруппы Аминокислоты. Белки
Аминокислоты. Белки Аммиак
Аммиак Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар Кремний и его соединения
Кремний и его соединения Закон действующих масс и его применение в аналитической химии
Закон действующих масс и его применение в аналитической химии Химическая связь
Химическая связь